
科目: 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)从海水中提取镁的流程如图所示:
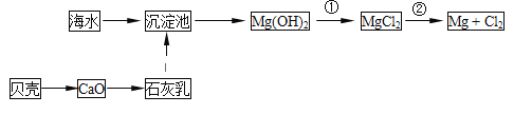
反应①的离子方程式为__;
反应②的化学方程式为__;
(2)海水提取溴流程:
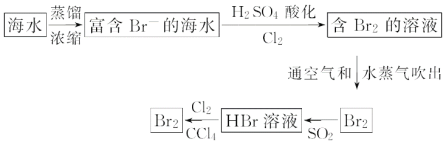
①该流程中涉及发生反应的离子方程式: __; ___;
②该流程中溴元素被氧化又被还原又被氧化的目的是:___;
③从最终溴的四氯化碳溶液中得到液溴,应采取的操作是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验装置的相关描述不正确的是
A.![]() 可用于叶绿体中色素的分离
可用于叶绿体中色素的分离
B.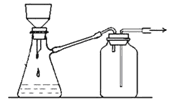 可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
可用于过滤颗粒很小的沉淀,不宜于过滤胶状沉淀
C. 可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离,然后松手,观察针筒是否能回到原来刻度处
D. 不可用来模拟氯碱工业
不可用来模拟氯碱工业
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室为探究铁与浓硫酸![]() 足量
足量![]() 的反应,并验证
的反应,并验证![]() 的性质,设计如图所示装置进行实验,下列说法不正确的是()
的性质,设计如图所示装置进行实验,下列说法不正确的是()

A.装置B中酸性![]() 溶液逐渐褪色,体现了二氧化硫的还原性
溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的![]()
C.装置D中品红溶液褪色可以验证![]() 的漂白性
的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是( )
A.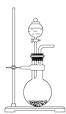 可用于实验室制取少量NH3或O2
可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
可用从a处加水的方法检验装置②的气密性
C. 实验室可用装置③收集H2、NH3
实验室可用装置③收集H2、NH3
D. 制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在一定温度下的恒容密闭容器中,可逆反应达到平衡状态时,一些宏观物理量恒定不变:a.各物质的浓度不变,b.平衡混合物中各组分的物质的量分数或质量分数不变,c.容器内气体压强不变,d.容器内气体密度不变,e.容器内气体颜色不变。
①能说明反应N2(g)+3H2(g) ![]() 2NH3(g)达到平衡状态的有__;
2NH3(g)达到平衡状态的有__;
②能说明反应H2(g)+I2(g) ![]() 2HI(g)达到平衡状态的有__;
2HI(g)达到平衡状态的有__;
(2)为了研究碳酸钙与盐酸反应的反应速率,某同学通过如图实验装置测定反应中生成的CO2气体体积,并绘制出如图所示的曲线。请分析讨论以下问题。
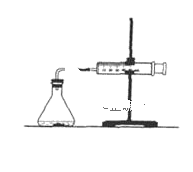
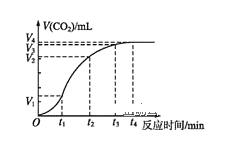
①化学反应速率最快的时间段是___(填选项),影响此时间段反应速率的主要因素是___;
A.O~t1 B.t1~t2 C.t2~t3 D.t3~t4
②为了减缓上述反应速率,欲向盐酸中加入下列物质,你认为可行的有___;
A.蒸馏水 B.NaCl固体 C.NaCl溶液 D.通入HCl气体
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()
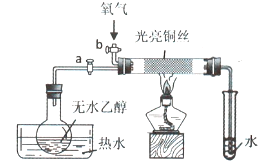
A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O2![]() 2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
①生成了__molSO3,SO2的起始物质的量浓度是__。
②2min内平均反应速率:v(O2)=__。
(2)某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
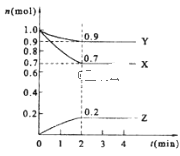
①X的转化率是__;
②由图中所给数据进行分析,该反应的化学方程式为___;
③若三种物质都是气体,则平衡时Y所占体积的百分比为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
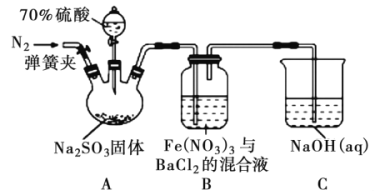
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是
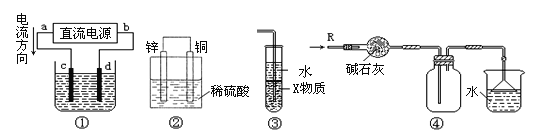
A. 若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B. 装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C. 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D. 装置④可用于收集氨气,并吸收多余的氨气
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)图中所示反应是__(填“吸热”或“放热”)反应,该反应的ΔH=__(用含E1、E2的代数式表示)。

(2)已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则其逆反应的活化能为___。
O2(g)=H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则其逆反应的活化能为___。
(3)依据事实,写出下列反应的热化学方程式:
①2molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出了29.8KJ的热量___。
②1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热,写出甲烷燃烧热的热化学方程式:__。
(4)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:

①从实验装置图看,图中尚缺少的一种玻璃用品是___。
②在大小烧杯之间填满碎泡沫(或纸条)其作用是__;
③该实验常用0.50mol·L-1HCl和0.55mol·L-1的NaOH溶液各50mL。解释NaOH的浓度稍大的原因__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com