
科目: 来源: 题型:
【题目】请回答下列问题:
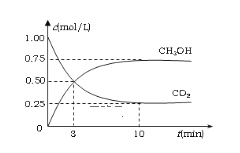
(1)在体积为1L的恒容密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g) △H =-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+ H2O(g) △H =-49.0kJ/mol 。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①氢气的转化率=__________________;
②该反应的平衡常数为___________(保留小数点后2位);
③下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去 D.再充入1mol CO2和3mol H2
④当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2。则c1______c2的关系(填>、<、=)。
(2)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______。
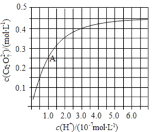
(3)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72) 随c(H+)的变化如图所示。①离子方程式表示Na2CrO4溶液中的转化反应_________________。②由图可知,溶液酸性增大,CrO42的平衡转化率____(填“增大“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)C是______溶液,D是______溶液。
(2)100mL0.01molL﹣1的B溶液与10mL 0.1molL﹣1的B溶液相比较,下列数值中,前者大于后者的是______ (填写序号)
①![]() ②
②![]() ③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 常温下铜片插入浓硫酸中 | 无明显现象 | 常温下铜被浓硫酸钝化 |
B | 将 | 溶液红色褪去 |
|
C | 等体积 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
D | 先向 | 开始有白色沉淀生成;后又有黑色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题:
(1)25℃时,pH=5的CH3COOH溶液中.加入少量NaOH固体,则溶液中![]() _______(填“增大”、“减小”或“不变”)。
_______(填“增大”、“减小”或“不变”)。
(2)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
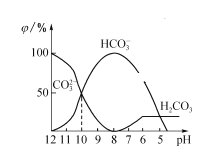
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为___________________________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh值为_________。
HCO3-+OH-的平衡常数Kh值为_________。
(3)生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
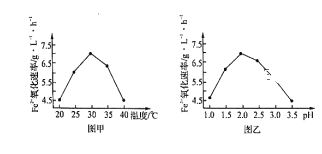
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是___________。
②由图甲和图乙判断使用硫杆菌的最佳条件为____________。在最佳条件下,该反应的加热
方式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】还原沉淀法是处理含铬![]() 和
和![]() 废水常用方法,过程如下:CrO42-
废水常用方法,过程如下:CrO42-![]()
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3 ,已知废水中Cr的含量为
Cr(OH)3 ,已知废水中Cr的含量为![]() ,当溶液中离子浓度小于
,当溶液中离子浓度小于![]() 时认为离子已经沉淀完全,常温下,
时认为离子已经沉淀完全,常温下,![]() 有关叙述中不正确的是
有关叙述中不正确的是
A.上述三个转化中只有一个涉及氧化还原反应
B.第二步离子方程式为:![]()
C.处理含铬废水可使用强碱![]() ,也可以使用弱碱氨水
,也可以使用弱碱氨水
D.当![]() 时,废水中铬元素沉淀完全
时,废水中铬元素沉淀完全
查看答案和解析>>
科目: 来源: 题型:
【题目】请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________。
(2)广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是 ___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -b kJ/mol
③ H2O(g)= H2O(l) ΔH3 = -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______。
A.HCN B.HClO C.CH3COOH D.H2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___(填元素符号)。
(2)b单质分子中σ键与π键的个数比为___。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___;这两种物质的互溶物中,存在的化学键有___(填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___(填化学式,下同);酸根呈正三角形结构的酸是___,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为![]() ,请补写e的元素符号并用“→”表示出其中的配位键___。
,请补写e的元素符号并用“→”表示出其中的配位键___。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
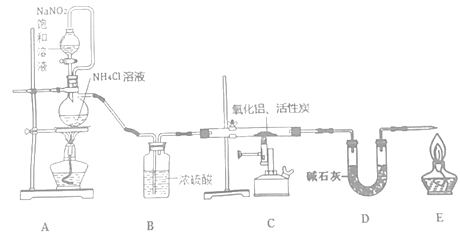
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
KSCN溶液 | Ⅰ | i.先加1 mL 0.1 mol/L FeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后退色 |
Ⅱ | iii.先滴加1 mL 0.05 mol/L Fe2(SO4)3溶液 iv.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | iii.溶液变红 iv.红色明显变浅 |
(1)①用离子方程式表示实验I溶液变红的原因___________
②针对实验I中红色褪去的原因,小组同学认为是SCN被酸性KMnO4氧化为SO42,并设计如图实验装置证实了猜想是成立的。
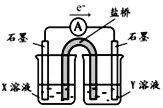
其中X溶液是_____________,检验产物SO42的操作及现象是__________。
(2)针对实验Ⅱ“红色明显变浅”,实验小组提出预测。
原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
原因②:SCN可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN![]() [Fe(SCN)]2+平衡左移,红色明显变浅。
[Fe(SCN)]2+平衡左移,红色明显变浅。
已知:Mg2+与SCN难络合,于是小组设计了如下实验:
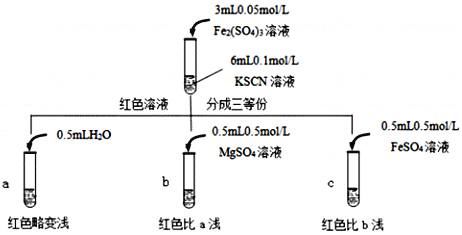
由此推测,实验Ⅱ“红色明显变浅”的原因是___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物和硫的氧化物是主要的大气污染物,烟气脱硫脱硝是环境治理的热点问题。回答下列问题:
(1)目前柴油汽车都用尿素水解液消除汽车尾气中的NO,水解液中的NH3将NO还原为无害的物质。该反应中氧化剂与还原剂物质的量之比为___。
(2)KMnO4/CaCO3浆液可协同脱硫,在反应中MnO4-被还原为MnO42-。
①KMnO4脱硫(SO2)的离子方程式为___。
②加入CaCO3的作用是___。
③KMnO4/CaCO3浆液中KMnO4与CaCO3最合适的物质的量之比为___。
(3)利用NaClO2/H2O2酸性复合吸收剂可同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如图所示:
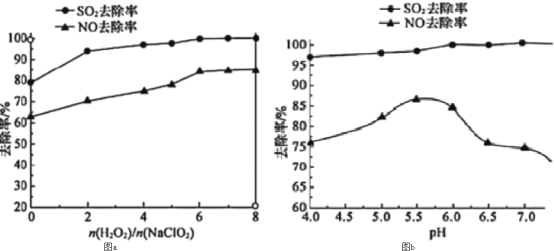
图a和图b中可知脱硫脱硝最佳条件是___。图b中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com