
科目: 来源: 题型:
【题目】25 ℃时,相同pH的两种一元酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )

A. HA一定是强酸
B. a点溶液的导电性大于b点溶液
C. a点的c(HA)大于b点的c(HB)
D. HA的酸性强于HB
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应热的说法正确的是( )
A.已知甲烷的燃烧热为890.3kJ·mol-1,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
C.已知C(石墨,s)=C(金刚石,s) ΔH=+1.9kJ·mol-1,说明金刚石具有的能量比石墨低
D.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.4kJ·mol-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,不溶于水和乙醚(易挥发的有机溶剂),微溶于乙醇,易溶于盐酸,其制备装置如下(已知Cr3+水溶液颜色为绿色,Cr2+水溶液颜色为蓝色):

(1)装置甲中连通管a的作用是________________________。
(2)向三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液:关闭k2打开k1,旋开分液漏斗的旋塞并控制好滴速;当观察到三颈烧瓶中溶液颜色__________________时,打开k2关闭k1,当观察到装置乙中出现大量红棕色晶体时,关闭分液漏斗的旋塞。
(3)装置乙中反应的离子方程式为__________________________________。
(4)将装置乙中混合物快速过滤、洗涤和干燥,称量得到a g [Cr(CH3COO)2]2·2H2O。洗涤时依次用去氧的冷蒸馏水、无水乙醇、乙醚洗涤。其中乙醇洗涤的目的是___________。
(5)若实验所取用的CrCl3溶液中含溶质b g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376) 的产率是________________。
(6)该实验装置有一个明显的缺陷,解决此缺陷的措施为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。(已知:2NO2 ![]() N2O4;△H<0)
N2O4;△H<0)

(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将___________(填:变大、变小、不变)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将_____,B中NO2的转化率将_______(填: 变大、变小、不变)。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,___________中的颜色较深。
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2。主要反应原理为:
主反应:a. 4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH1;
4N2(g)+6H2O(g) ΔH1;
副反应:b. 4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;
2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol;
c. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
①主反应的ΔH1=____________。
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图所示,试分析脱硝的适宜温度是______(填序号)。

a.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_______________。
(2)已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如上如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是____________,理由是___________。
7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如上如图所示。该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是____________,理由是___________。

(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。(用分数表示)
=___________。(用分数表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上利用CO与H2反应合成优质燃料甲醇。
(1)已知燃烧6.4g甲醇放出145.16kJ热量,请写出表示甲醇燃烧热的热化学方程式:_______。
(2)甲醇燃料电池具有能量密度大,对环境污染小等优点,有一种甲醇碱性燃料电池装置如图所示:

①甲醇应由______(选填“a”或“b”)极通入,其电极反应式为___________;
②当电路中通过1.2mol电子时,a极室n(OH-)减少____________mol;
(3)已知:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-129.0 kJ·mol-1,在一恒容密闭容器中,按照a mol CO和2a mol H2投料,测得CO在不同温度下的平衡转化率与压强关系如图所示,则下列说法正确的是____。
CH3OH(g) ΔH=-129.0 kJ·mol-1,在一恒容密闭容器中,按照a mol CO和2a mol H2投料,测得CO在不同温度下的平衡转化率与压强关系如图所示,则下列说法正确的是____。

a.温度:T1>T2>T3
b.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
c.正反应速率:v(a)<v(c)、v(b)>v(d)
d.平衡常数:K(a)<K(c)、K(b)=K(d)
查看答案和解析>>
科目: 来源: 题型:
【题目】CH4和H2O(g)在催化剂表面发生反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g),该反应仅在高温下能自发进行。
CO(g)+3H2(g),该反应仅在高温下能自发进行。
(1)该反应的 ΔH ____0(填“<” “>” 或 “=”)。
(2)T ℃时,向2L密闭容器中投入2mol CH4和1.5mol H2O(g),发生上述反应,平衡时CH4的转化率为50%,该温度下反应的平衡常数K=_____。
(3) T ℃时,向1 L密闭容器中投入2 mol CH4、1 mol H2O(g)、3 mol CO、2 mol H2,则反应的v(正)___v(逆) (选填“<” “>”或“=”)
(4)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) ΔH1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。

①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,CO转化率最高的是容器______。
查看答案和解析>>
科目: 来源: 题型:
【题目】用![]() 代替
代替![]() 与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。
与燃料反应是一种高效、清洁、经济的新型燃烧技术,如图所示。

燃烧器中反应①![]() (主反应)
(主反应)
反应②![]() (副反应)
(副反应)
再生器中反应:![]()
(1)气化反应器中发生反应的化学方程式是 ______。
(2)燃烧器中![]() 物质的量分数随温度T、压强p
物质的量分数随温度T、压强p![]() 的变化曲线见图,从图中可以得出三条主要规律:
的变化曲线见图,从图中可以得出三条主要规律:

①其他条件不变,温度越高,![]() 含量越高;
含量越高;
②______ ;
③______ ;
由图可知,为减少![]() 的排放量,可采取的措施是 ______。
的排放量,可采取的措施是 ______。
(3)该燃烧技术中可循环的物质除![]() 、CaS外,还有 ______
、CaS外,还有 ______ ![]() 写名称
写名称![]() 。
。
(4)欲采用氯化钯![]() 溶液除去
溶液除去![]() 中的CO,完成以下实验装置图:______
中的CO,完成以下实验装置图:______![]() 注:
注:![]() 。
。

(5)CO2在自然界循环时可与![]() 反应,
反应,![]() 是一种难溶物质,其
是一种难溶物质,其![]() 。现将
。现将![]()
![]() 的
的![]() 溶液与一定浓度的
溶液与一定浓度的![]() 溶液等体积混合生成沉淀,计算应加入
溶液等体积混合生成沉淀,计算应加入![]() 溶液的最小浓度为 ______(保留二位有效数字)。
溶液的最小浓度为 ______(保留二位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】人尿中可以分离出具有生长素效应的化学物质——吲哚乙酸,其结构简式如图所示。下列有关说法正确的是( )

A.吲哚乙酸分子中所有碳原子全部共面
B.吲哚乙酸苯环上的二氯代物共有四种
C.1 mol吲哚乙酸与足量氢气发生反应,最多消耗5 mol H2
D.吲哚乙酸可以发生取代反应、氧化反应和中和反应
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用还原沉淀法处理含铬废水(![]() 和
和![]() ),其流程为:
),其流程为:
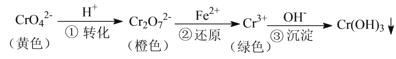
已知:步骤③生成的![]() 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:![]()
![]() ,
,![]()
下列有关说法不正确的是
A.步骤①中当![]() 时,说明反应:
时,说明反应:![]() 达到平衡状态
达到平衡状态
B.若向![]() 溶液中加NaOH浓溶液,溶液可由橙色变黄色
溶液中加NaOH浓溶液,溶液可由橙色变黄色
C.步骤②中,若要还原![]() 离子,需要
离子,需要![]()
D.步骤③中,当将溶液的pH调节至5时,可认为废水中的铬元素已基本除尽![]() 当溶液中
当溶液中![]() 时,可视作该离子沉淀完全
时,可视作该离子沉淀完全![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com