
科目: 来源: 题型:
【题目】I已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表(单位省略):
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10-5 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=6.2×10-10 |
(1)写出碳酸的第一步电离方程式___。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,pH由大到小的顺序为___(填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为___。
(4)将浓度为0.02mol/L的HCN与0.01mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是___。
a.c(H+)>c(OH-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl溶液中,阴离子总浓度由大到小的顺序为___(填序号)。
Ⅱ.酸性高锰酸钾标准溶液是实验室常用的氧化还原滴定标准试剂。
(6)某同学用0.1000mol/L的酸性高锰酸钾标准溶液滴定某试样中过氧化氢的含量,反应原理为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定时,用___装KMnO4溶液。
②滴定到达终点的现象是___。
③用移液管吸取25.00m试样置于锥形瓶中,重复滴定四次,每次消耗的酸性KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 17.00 | 16.90 |
则试样中过氧化氢的浓度为___mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究电化学原理与应用有非常量要的意义。
(1)锌锰电池(俗称干电池)是一种一次电池,生活中应用广泛。若锌锰电池工作环境为酸性,则此时负极上的电极反应式为:___。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
①放电时正极反应为(离子方程式):___。
②铅蓄电池放电时,当消耗了10.35gPb时,转移的电子的物质的量为___。
(3)如图1是金属(M)—空气电池的工作原理,我国首创的海洋电池以铅板为负极,铂网为正极,海水为电解质溶液,则该电池反应方程式为:___。二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示,则Pt2上的电极反应式为:___。
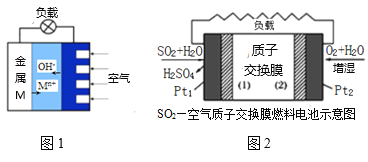
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)[Fe2(OH)n(SO4)3-0.5n]m和绿矾FeSO4·7H2O,其过程如图所示,下列说法不正确的是
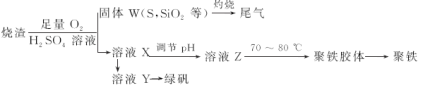
A.炉渣中FeS与硫酸、氧气反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S+6H2O
B.溶液Z加热到70~80 ℃的目的是促进Fe3+的水解
C.溶液Y经蒸发浓缩、冷却结晶、过滤等步骤可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若pH偏小导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目: 来源: 题型:
【题目】铜的两种氧化物在化工生产中都有着重要的用途。
I.CuO可用于制备Cu2O。
已知:①2Cu2O(s)![]() 4Cu(s)+O2(g) △H1=+338kJ·mol-1;
4Cu(s)+O2(g) △H1=+338kJ·mol-1;
②2CuO(s)![]() 2Cu(s)+O2(g) △H2=+314kJ·mol-1。
2Cu(s)+O2(g) △H2=+314kJ·mol-1。
(1)CuO分解生成2molCu2O的热化学方程式为___。
(2)温度为T时,向5L恒容密闭容器中加入80gCuO制备Cu2O,5min时恰好达到平衡,测得容器中Cu2O的物质的量为0.4mol。
①该反应的平衡常数K=___。
②5min时缩小容器容积,重新达到平衡时O2的浓度___(填“增大”、“减小”或“不变”)。
(3)研究表明,在CuO中加入适量碳粉有利于制得纳米级Cu2O,下列说法正确的是___(填选项字母)。
A.碳与氧气反应放热,加快反应速率 B.生成CO气体,使固体颗粒容易分散
C.CO可以将Cu2O还原为铜粉 D.CO作该反应的催化剂
Ⅱ.CuO可用于冶炼铜(已知:CO的燃烧热△H=—283kJ·mol-1);一定条件下,将1molCuO和0.5molCO加入2L密闭容器中发生反应,t1时达到平衡,t2后改变容器中的条件,用CO表示的反应速率(v)与时间(t)的关系如图所示(三个阶段改变的条件为温度、压强、浓度中的一个)。
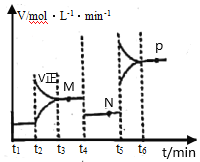
(4)t4时改变的条件为___。
(5)M、N、P三点对应状态下,CO的转化率a(M)、a(N)、a(P)的大小关系为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种微生物电池可进行多种污水净化和海水淡化的综合处理,该电池装置的示意图如图所示,其中污
水中的有机物用C6H10O5表示,海水用食盐水代替。下列说法正确的是

A. b膜为阴离子交换膜
B. 处理后的含NO3-污水的pH降低
C. 负极反应式为C6H10O5+7H2O+24e-==6CO2↑+24H+
D. 导线中流过lmol电子,理论上有1molCl-通过a膜
查看答案和解析>>
科目: 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
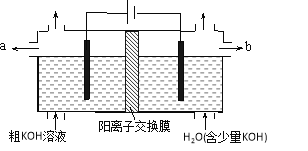
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.18 g D2O和18 g H2O中含有的质子数均为10NA
B.2 L 0.5 mol·L-1H2S溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol SO2与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)![]() CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
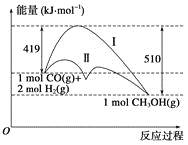
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5mol/L、MgCO3的饱和溶液中c(Mg2+)为2.6×10-3mol/L.若在5mL浓度均为0.01mol/L的CaCl2和MgCl2溶液中,逐滴加入5mL 0.012mol/LNa2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A. 25℃时,Ksp(CaCO3)=2.8×10-9
B. 加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C. 滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO3-)>c(OH-)
D. 滤液M中: 
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com