
科目: 来源: 题型:
【题目】“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )

A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三价铝离子
C.正极反应为:NiCl2+2e-=Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→ +H2O,下列有关三聚氰胺的说法正确的是
+H2O,下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3
B.属于共价化合物
C.分子中既含极性键,又含非极性键
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,一定量的Na2C03与盐酸混合所得溶液中,部分含碳微粒的物质的量分数(![]() )与pH的关系如图所示。下列说法正确的是
)与pH的关系如图所示。下列说法正确的是

A. 曲线X表示的微粒为CO32-
B. pH=6.3时,![]() (CO32-)+
(CO32-)+![]() (HCO3-)+
(HCO3-)+![]() (H2CO3)=1.0
(H2CO3)=1.0
C. pH=7时,c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)=c(H+)
D. pH=10.3 时,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO3-)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向IL0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是

A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-)-n(H+)=(a-0.05)mol
C.随者NaOH的加入,c(H+)/c(NH4+)不断增大
D.当n(NaOH)=0.1mol时,c(OH-)>c(Cl-)-c(NH3·H20)
查看答案和解析>>
科目: 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D. 让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目: 来源: 题型:
【题目】求下列溶液的pH(常温条件下)(已知lg2=0.3)
(1)0.005 mol·L-1的H2SO4溶液________
(2)已知CH3COOH的电离常数Ka=1.8×10-5,0.1 mol·L-1的CH3COOH溶液________
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度=![]() ×100%)________
×100%)________
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合________
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合________
(6)将pH=3的HCl与pH=3的H2SO4等体积混合________
(7)0.001 mol·L-1的NaOH溶液________
(8)pH=2的盐酸与等体积的水混合________
(9)pH=2的盐酸加水稀释到1 000倍________
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列有关叙述正确的是( )
①1mol苯中含有的碳碳双键数为3NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N﹣H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为0.3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8g Fe与足量水蒸气完全反应失去0.8NA个电子.
A. ①④⑤⑦ B. ②⑤⑧ C. ②④⑤⑦⑧ D. ⑤⑥⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知Ksp(AgCl)=1.8×10-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是________?
(2)已知Ksp[Mg(OH)2]=1.8×10-11,则将Mg(OH)2放入蒸馏水中形成饱和溶液,溶液的pH为________?
(3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的pH是________?当Mg2+完全沉淀时,溶液的pH为________?
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,现在向0.001 mol·L-1K2CrO4和0.01 mol·L-1KCl混合液中滴加0.01 mol·L-1AgNO3溶液,通过计算回答:
(1)Cl-、CrO42-谁先沉淀________?
(2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是________?(设混合溶液在反应中体积不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】随着国家大力发展清洁能源产业的要求,以太阳能为代表的新能源产业规模得以迅速地壮大。试完成下列问题。
(1)现在电瓶车所用电池一般为铅蓄电池,如图所示:
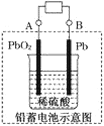
这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。则电池放电时,溶液的pH会________(填“增大”或“减小”),写出负极反应式为____________。充电时,铅蓄电池的负极应与充电器电源的________极相连。
2PbSO4+2H2O。则电池放电时,溶液的pH会________(填“增大”或“减小”),写出负极反应式为____________。充电时,铅蓄电池的负极应与充电器电源的________极相连。
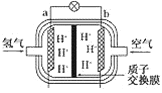
(2)为体现节能减排的理念,中国研制出了新型燃料电池汽车,该车装有“绿色心脏”——质子交换膜燃料电池。如图是某种质子交换膜燃料电池原理示意图。该电池的正极是________(填“a”或“b”,下同)极,工作过程中,质子(H+)透过质子交换膜移动到________极。写出该电池的负极反应式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com