
科目: 来源: 题型:
【题目】一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O]常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质可溶于水,难溶于乙醇,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol·L-1的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol·L-1稀盐酸、0.500 mol·L-1 的NaOH溶液来制备一水硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制取
①实验室用铜与浓硫酸制备硫酸铜溶液时,往往会产生有污染的SO2气体,随着硫酸浓度变小,反应会停止,使得硫酸利用率比较低。
②实际生产中往往将铜片在空气中加热,使其氧化生成CuO,再溶解在稀硫酸中即可得到硫酸铜溶液;这一过程缺点是铜片表面加热易被氧化,而包裹在里面的铜得不到氧化。
③所以工业上进行了改进,可以在浸入硫酸中的铜片表面不断通 O2,并加热;也可以在硫酸和铜的混合容器中滴加 H2O2 溶液。
④趁热过滤得蓝色溶液。
(1)某同学在上述实验制备硫酸铜溶液时铜有剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因________________。
(2)若按③进行制备,请写出Cu在H2O2 作用下和稀硫酸反应的化学方程式_______________。
(3)H2O2溶液的浓度对铜片的溶解速率有影响。现通过下图将少量30%的H2O2溶液浓缩至40%,在B处应增加一个设备,该设备的作用是____________馏出物是 ______________________。


II.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作
(1)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为 Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(2)继续滴加 NH3·H2O,会转化生成深蓝色溶液,请写出从深蓝色溶液中析出深蓝色晶体的方法____________。并说明理由____________。
Ⅲ.产品纯度的测定
精确称取 mg 晶体,加适量水溶解,注入图示的三颈瓶中,然后逐滴加入足量 NaOH 溶液, 通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用 V1mL 0.500mol·L-1 的盐酸标准溶液完全吸收。取下接收瓶,用 0.500 mol·L-1 NaOH 标准溶液滴定过剩的 HCl(选用 甲基橙作指示剂),到终点时消耗 V2mLNaOH 溶液。

1.水 2.长玻璃管 3.10%NaOH溶液 4.样品液 5.盐酸标准溶液
(1)玻璃管2的作用________________。
(2)样品中产品纯度的表达式________________。(不用化简)
(3)下列实验操作可能使氨含量测定结果偏低的原因是_________________
A.滴定时未用 NaOH 标准溶液润洗滴定管
B.滴定过程中选用酚酞作指示剂
C.读数时,滴定前平视,滴定后俯视
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
E.由于操作不规范,滴定前无气泡,滴定后滴定管中产生气泡
查看答案和解析>>
科目: 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是

A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物A 是农药生产中的一种中间体,其结构简式如图:
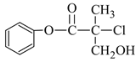
下列有关叙述中正确的是
A.l mo1 A和足量的H2发生加成反应,最多可以消耗4 mol H2
B.有机物A可以和Br2的CCl4溶液发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.l mo1 A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH
查看答案和解析>>
科目: 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,请回答下列问题:
(1)金红石(TiO2)是钛的主要矿物之一,基态Ti原子价层电子的排布图为_________,基态O原子电子占据最高能级的电子云轮廓图为 __________形。
(2)以TiO2为原料可制得TiCl4,TiCl4的熔、沸点分别为205K、409K,均高于结构与其相似的CCl4,主要原因是 __________________。
(3)TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有 ________。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.范德华力
(4)TiCl4可与CH3CH2OH、HCHO、CH3OCH3等有机小分子形成加合物。上述三种小分子中C原子的VSEPR模型不同于其他分子的是 _____,该分子中C的轨道杂化类型为________ 。
(5)TiO2与BaCO3一起熔融可制得钛酸钡。
①BaCO3中阴离子的立体构型为 ________。
②经X射线分析鉴定,钛酸钡的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),则钛酸钡的化学式为 _________。已知晶胞边长为a pm,O2-的半径为b pm,则Ti4+、Ba2+的半径分别为____________pm、___________pm。

查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为“21 世纪的清洁燃料”。利用甲醇脱水可制得二甲醚,反应方程式如下: 2CH3OH(g)![]() CH3OCH3(g) + H2O(g) ΔH1
CH3OCH3(g) + H2O(g) ΔH1
(1)二甲醚亦可通过合成气反应制得,相关热化学方程式如下:
2H2(g)+ CO(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH3
CO2(g)+ H2(g) ΔH3
3H2(g)+ 3CO(g)![]() CH3OCH3(g)+ CO2 (g) ΔH4
CH3OCH3(g)+ CO2 (g) ΔH4
则ΔH1= ________(用含有ΔH2、ΔH3、ΔH4的关系式表示)。
(2)经查阅资料,上述反应平衡状态下 Kp 的计算式为:![]() (Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
(Kp 为以分压表示的平衡常数,T 为热力学温度)。且催化剂吸附 H2O(g)的量会受压强影响,从而进一步影响催化效率。)
①在一定温度范围内,随温度升高,CH3OH(g)脱水转化为二甲醚的倾向_______ (填“增大”、“不变”或“减小”)。
②某温度下(此时 Kp=100),在密闭容器中加入CH3OH,反应到某时刻测得各组分的分压如下:
物质 | CH3OH | CH3OCH3 | H2O |
分压/MPa | 0.50 | 0.50 | 0.50 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
③200℃时,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为 _______(填标号)。
A.<![]() B.
B.![]() C.
C.![]() ~
~![]() D.
D.![]() E.>
E.>![]()
④300℃时,使 CH3OH(g)以一定流速通过催化剂,V/F (按原料流率的催化剂量)、压强对甲醇转化率影响如图1所示。请解释甲醇转化率随压强(压力)变化的规律和产生这种变化的原因,规律__________________________,原因_______________________。

(3)直接二甲醚燃料电池有望大规模商业化应用,工作原理如图2所示。
①该电池的负极反应式为:_______________。
②某直接二甲醚燃料电池装置的能量利用率为 50%,现利用该燃料电池电解氯化铜溶液,若消耗 2.3g 二甲醚,得到铜的质量为_______ g。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100molL-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )

A. 曲线②代表滴定CH3COOH溶液的曲线
B. 在相同温度下,P点水电离程度大于M点
C. M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1
D. N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是

A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
查看答案和解析>>
科目: 来源: 题型:
【题目】PET(![]() ,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩尔质量)
(忽略端基的摩尔质量)
查看答案和解析>>
科目: 来源: 题型:
【题目】山梨酸是应用广泛的食品防腐剂,其结构如图所示,下列关于山梨酸的说法错误的是( )

A.分子式为C6H8O2
B.1mol该物质最多可与3molH2发生加成反应
C.可使酸性KMnO4溶液褪色
D.可与碳酸氢钠溶液反应生成CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】1,4-二氧六环的一种合成方法如下,下列说法正确的是
CH2=CH2![]()
![]()
![]()
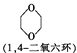
A.反应①、②的原子利用率均为100%
B.反应②的反应类型是加成聚合反应
C.环氧乙烷分子中的所有原子处于同一平面
D.与1,4-二氧六环互为同分异构体的酯类只有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com