
科目: 来源: 题型:
【题目】绝热容器中发生反应:3Z(s)![]() X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
A.将0.3 mol Z置于容器中充分反应生成气体的物质的量一定小于0.3 mol
B.达到化学平衡状态时,气体平均摩尔质量不变
C.容器中放入3mol Z,达到化学平衡状态时,反应吸收的总热量为a kJ
D.容器温度不变,反应已经达到平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,HF的电离常数Ka=6.61×10-4,NH3﹒H2O电离常数Kb=1.78×10-5。下列说法正确的是
A.NH4F溶液中![]()
B.NH4F溶液中水的电离程度小于纯水的电离程度
C.NH4F溶液中F-的水解平衡常数Kh(F-)=1.51×10-11
D.NH4F与NH4Cl的混合溶液中有下列关系:c(NH4+)>c(F-)+c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
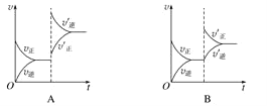
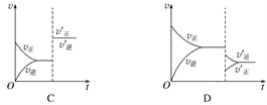
(1)加催化剂对反应速率影响的图象是__________(填字母,下同),平衡__________移动。
(2)升高温度对反应速率影响的图象是__________,平衡向__________方向移动。
(3)增大反应容器体积对反应速率影响的图象是__________,平衡向__________方向移动。
(4)增大O2的浓度对反应速率影响的图象是__________,平衡向__________方向移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0
B.CaCO3(s)=CaO(s)+CO2(g) △H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
D.2CO(g)=2C(s)+O2(g) △H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:![]() ,下图中的曲线是不同温度下的平衡转化率曲线,图中有a、b、c三点,则下列说法正确的是
,下图中的曲线是不同温度下的平衡转化率曲线,图中有a、b、c三点,则下列说法正确的是
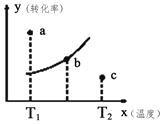
A.该反应是放热反应
B.b点时有![]()
C.![]() 温度下,若由a点达到平衡,可以采取增大压强的方法
温度下,若由a点达到平衡,可以采取增大压强的方法
D.c点![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知N2(g)+3H2(g)![]() 2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
2NH3(g) △H=-92.3kJ/mol,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态I;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态II,则下列说法正确的是
A.两个平衡状态的平衡常数的关系:KⅠ<KⅡ
B.H2的百分含量相同
C.N2的转化率:平衡I<平衡Ⅱ
D.反应放出的热量:QⅠ=QⅡ<92.3kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,在100℃开始升华,157℃时开始分解.
(1)探究草酸的酸性
①已知:25℃H2C2O4的电离常数 K1=5.4×10-2,K2=5.4×10-5;H2CO3的电离常数 K1=4.5×10-7,K2=4.7×10-11,则下列化学方程式正确的是___(填选项序号,下同)
A.H2C2O4+CO32-=HCO3-+HC2O4- B.HC2O4-+CO32-=HCO3-+C2O42-
C.H2O+CO2+C2O42-=HC2O4-+HCO3- D.C2O42-+CO2+H2O=H2C2O4+CO32-
②向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液.混合溶液中c(H+)>c(OH﹣),下列说法中正确的是___.
A.c(H2C2O4)>c(HC2O4-)
B.c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH﹣)
C.c(OH﹣)=c(H+)+2c(H2C2O4)+c(HC2O4-)
D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(2)用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应).
实验步骤:准确称取1g样品Na2C2O4固体,配成100mL溶液,取出20.00mL于锥形瓶中.再向瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(已知:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O)
高锰酸钾溶液应装在__________滴定管中。(填“酸式”或“碱式”)
②滴定至终点时的实验现象是:__________________________________________。
③下列操作可能使测量结果偏高的是_____________;
A.盛装的Na2C2O4的滴定管没润洗
B.盛装高锰酸钾溶液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
C.读数时滴定前仰视,滴定后俯视 D.锥形瓶中残留少量水
④计算样品中Na2C2O4的纯度____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________.已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH=_____.
②泡沫灭火器中通常装有NaHCO3 溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是_____.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是___。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3![]() H++ HSO3﹣的平衡常数的数值____.
H++ HSO3﹣的平衡常数的数值____.
查看答案和解析>>
科目: 来源: 题型:
【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
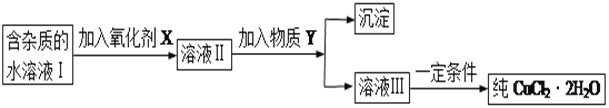
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
查看答案和解析>>
科目: 来源: 题型:
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com