
科目: 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是( )

A.二茂铁分子中存在π键
B.lmol环戊二烯(![]() )中含有σ键的数目为11NA
)中含有σ键的数目为11NA
C.Fe2+的电子排布式为ls 22s 22p63s23p63d54s1
D.二茂铁中Fe2+与环戊二烯离子(C5H5-)之间为配位键
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是( )

A.化合物甲、乙均为手性分子
B.化合物甲中最多有8个原子共平面
C.化合物乙中采取sp3杂化的原子只有N、C
D.化合物甲的沸点明显高于化合物乙
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一种综合处理SO2废气的工艺流程。下列说法正确的是

A.溶液酸性:A>B>C
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2 =2Fe3++2H2O
C.向B溶液中滴加KSCN溶液,溶液可能会变为红色
D.加氧化亚铁可以使溶液C转化为溶液A
查看答案和解析>>
科目: 来源: 题型:
【题目】甲胺(CH3NH2)是一种一元弱碱,其电离方程式为:CH3NH2 + H2O ![]() CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
CH3NH3+ + OH-。常温下,向20.0 mL 0.10 mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是

A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,根据a点可知甲胺的电离平衡常数Kb=10 -3.4
C. b点可能存在关系:c(Cl-) > c(CH3NH3+) > c(H+) = c(OH-)
D. V=20.00mL时,溶液呈弱酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是

A.Y、W的最高价氧化物对应的水化物均为强酸
B.Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v的电子式可表示为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】目前低碳经济已成为科学家研究的主要课题之一,如何降低大气中![]() 的含量及有效地开发利用
的含量及有效地开发利用![]() ,引起全世界的关注:
,引起全世界的关注:
(1)用电弧法合成的储氢材料常伴有大量的碳纳米颗粒![]() 杂质
杂质![]() ,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为
,这些杂质颗粒通常用硫酸酸化的锰酸钾氧化除去,在反应中,杂质碳被氧化为无污染气体而除去,Mn元素转变为![]() ,请写出对应的化学方程式并配平: ______ ;
,请写出对应的化学方程式并配平: ______ ;
(2)将不同量的![]() 和
和![]() 分别通入到体积为2L的恒容密闭容器中,进行反应
分别通入到体积为2L的恒容密闭容器中,进行反应![]()
![]() ,得到如下两组数据:
,得到如下两组数据:
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所 需时间 | ||
| CO |
| CO | |||
1 | 650 | 2 | 4 |
|
| 5 |
2 | 900 | 1 | 2 |
|
| 3 |
①实验2条件下平衡时![]() 体积分数为 ______ ;
体积分数为 ______ ;
②下列方法中可以证明上述已达平衡状态的是 ______ ;
![]() 单位时间内生成nmol
单位时间内生成nmol![]() 的同时生成nmolCO
的同时生成nmolCO
![]() 容器内压强不再变化
容器内压强不再变化![]() 混合气体密度不再变化
混合气体密度不再变化
![]() 混合气体的平均相对分子质量不再变化
混合气体的平均相对分子质量不再变化![]() 的质量分数不再变化
的质量分数不再变化
③已知碳的气化反应在不同温度下平衡常数的对数值![]() 如下表,则反应
如下表,则反应![]() ,在900K时,该反应平衡常数的对数值
,在900K时,该反应平衡常数的对数值![]() ______ .
______ .
气化反应式 | lgK | ||
700K | 900K | 1200K | |
|
|
|
|
|
|
|
|
(3)在高温下一氧化碳可将二氧化硫还原为单质硫.已知:
![]()
![]()
![]()
![]()
![]()
![]()
请写出CO除![]() 的热化学方程式 ______ .
的热化学方程式 ______ .
(4)![]() 时,
时,![]() 和
和![]() 的溶度积常数分别是
的溶度积常数分别是![]() 和
和![]() ,某含有
,某含有![]() 沉淀的悬浊液中
沉淀的悬浊液中![]() ,如果加入等体积的
,如果加入等体积的![]() 溶液,若要产生
溶液,若要产生![]() 沉淀,加入
沉淀,加入![]() 溶液的物质的量浓度最小是 ______
溶液的物质的量浓度最小是 ______ ![]() .
.
(5)![]() 时,在
时,在![]() 醋酸中加入V
醋酸中加入V![]() 溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .
溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 ______ .

A.![]() 的
的![]() 溶液和
溶液和![]() 的
的![]() 溶液中,由水电离出的
溶液中,由水电离出的![]() 相等
相等
B.①点时![]() ,此时溶液中,
,此时溶液中,![]()
C.②点时,溶液中的![]()
D.③点时![]() ,此时溶液中
,此时溶液中![]()
(6)如图是一种新型燃料电池,它以CO为燃料,一定比例的![]() 和
和![]() 熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:
熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电进行粗铜的精炼实验.回答下列问题:

①写出A极发生的电极反应式 ______ ;
②要用燃料电池为电进行粗铜的精炼实验,则B极应该与 ______ 极![]() 填“C”或“D”
填“C”或“D”![]() 相连.
相连.
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
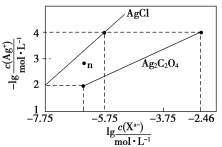
A.Ksp(Ag2C2O4)的数量级等于10-11
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为109.04
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如下:

已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________(写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为_______________。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为______________[Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:![]() 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO42-,若pH过高,铁电极区会产生红褐色物质。

①电解时阳极的电极反应式为________________,离子交换膜(b))为______(填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是![]()
A. 如图表示同温度下,
如图表示同温度下,![]() 的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 如图表示
如图表示![]()
![]() 溶液滴定
溶液滴定![]()
![]()
![]() 溶液所得到的滴定曲线
溶液所得到的滴定曲线
C. 如图表示压强对可逆反应
如图表示压强对可逆反应![]() 的影响,乙的压强比甲的压强大
的影响,乙的压强比甲的压强大
D. 如图若除去
如图若除去![]() 溶液中的
溶液中的![]() 可向溶液中加入适量CuO至pH在4左右
可向溶液中加入适量CuO至pH在4左右
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com