
科目: 来源: 题型:
【题目】下列实验误差分析错误的是( )
A.用湿润的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.容量瓶中含有少量蒸馏水对所配的溶液无影响
D.测定中和反应的中和热时,保温效果越好,测定误差越小
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列物质的溶液:①CH3COOH ②HCl ③ NaHSO4
(1)若将c(H+)均为0.1mol·L-1的三种溶液加水稀释100倍后,其中c(H+)最大的是________(用序号表示,下同)。
(2)若三种溶液的c(H+)均为0.1mol·L-1,分别向三种溶液中投入大小形状都相同的锌粒,一段时间后反应最快的是________________。
(3)若测定物质的量浓度相同的三种溶液的导电能力,小灯泡亮度最大的是_______________。
(4)若将6 g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为________________,经测定溶液中c(CH3COO-)为1.4×10-3mol·L-1,此温度下醋酸的电离常数K=_____________,加入少量 NaHSO4固体后,K____________(填“变大”、“不变”或“变小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O22SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)=C(金刚石,s) ![]() >0,则金刚石比石墨稳定
>0,则金刚石比石墨稳定
C.已知2C(s)+2O2(g)=2CO2(g) ![]() 1 2C(s)+O2(g)=2CO(g) △H2则△H1<△H2
1 2C(s)+O2(g)=2CO(g) △H2则△H1<△H2
D.已知H+(aq)+OH-(aq)=H2O(l) ![]() =-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ
=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米氧化锌是一种多功能性的新型无机材料,在橡胶、玻璃、涂料等各个领域广泛的应用。工业由粗氧化锌(含少量FeO、CuO 等杂质) 制备活性氧化锌的工业流程如下:

已知:Fe3+、Fe2+、Cu2+完全沉淀的pH分别是:3.2,8.1,6.7
(1)“酸浸”时用的硫酸溶液的密度为1.4g/mL,质量分数为70%,则该硫酸的物质的量浓度为____。
(2)焙烧前粉碎的目的是____________________________________________。
(3)滤液中加锌粉的目的是_____________________________________。
(4)物质A的主要成分_______________(填化学式),检验A中阳离子的方法是_______________。
(5)滤液中加H2O2发生反应的离子方程式__________________________。
(6)6.82g碱式碳酸锌[aZn(OH)2·bZnCO3·cH2O]恰好溶解在40mL3mol/LHCl中,同时产生448mLCO2(标准状况下),试推算碱式碳酸锌的化学式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)已知:①CO燃烧热的△H1=-283.0kJ·mol-l,②N2(g)+O2(g) ![]() 2NO(g) △H2=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)
2NO(g) △H2=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g); △H=___。
N2(g)+2CO2(g); △H=___。
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示.
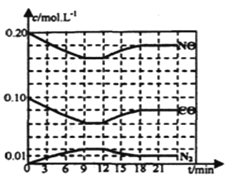
①该反应第一次达到平衡时的平衡常数为________。
②第12min时改变的条件是________。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将________移动(填“正向”、“逆向”或“不”).
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是________。
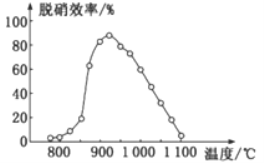
②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取氯气的装置如图:
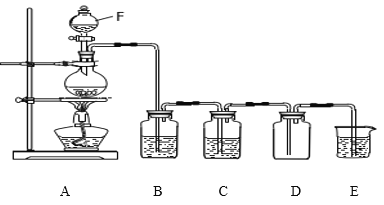
(1)仪器F的名称是_____________;按图组装好装置后首先要进行的操作是:_________________。
(2)写出E中发生反应的离子方程式:_____________________________________________________。
(3)实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,则该反应的氧化产物是_____________________。
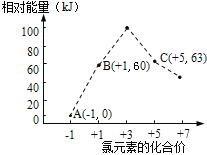
(4)氯元素能形成多种离子。在水溶液中1 mol Cl-、1 molClOx-(x=1,2,3,4)能量的相对大小如图所示,试判断B→A+C反应是___________反应(填“吸热”或“放热”);若有1.5molB发生反应,转移电子的物质的量为___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细![]() 氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为
氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() ,其制备实验流程如图1:
,其制备实验流程如图1:
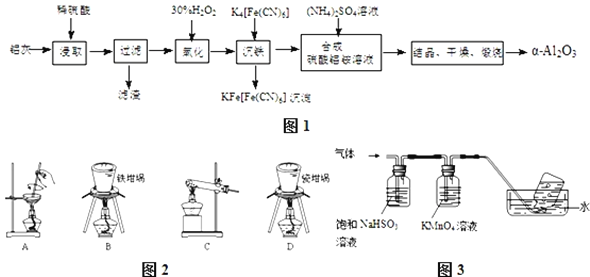
![]() 铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
![]() 用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______
用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______ ![]() 填选项编号
填选项编号![]() .
.
![]() 在实验流程中,加
在实验流程中,加![]() 的
的![]() 溶液发生的离子反应方程式为 ______ .
溶液发生的离子反应方程式为 ______ .
![]() 验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
![]() 若用调节pH溶液“沉铁”,则得到
若用调节pH溶液“沉铁”,则得到![]() ,已知:
,已知:![]() 时,
时,![]() ,则该温度下反应
,则该温度下反应![]() 的平衡常数为 ______ .
的平衡常数为 ______ .
![]() 煅烧硫酸铝铵晶体,发生的主要反应为:
煅烧硫酸铝铵晶体,发生的主要反应为:![]()
![]()
![]() ,将产生的气体通过图3所示的装置.
,将产生的气体通过图3所示的装置.
①集气瓶中收集到的气体是 ______ ![]() 填化学式
填化学式![]() .
.
②![]() 溶液褪色,发生的离子反应方程式为 ______ .
溶液褪色,发生的离子反应方程式为 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g);ΔH=-90.8kJ/mol。
CH3OH(g);ΔH=-90.8kJ/mol。
(1)该反应的平衡常数表达式为:K=____,如升高温度,K值将______(填:增大、减小或不变)。
(2)以下各项能说明该反应达到平衡状态的是____________.
A.混合气体的密度保持不变 B.甲醇的质量分数保持不变
C.CO的浓度保持不变 D.2v逆(H2)=v正(CH3OH)
(3)在210°C、240°C和270°C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
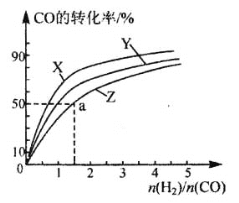
如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_____。由起始达到a点所需时间为5min,则H2的反应速率为:_______________mol/(L·min)。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
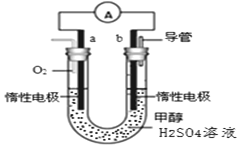
①该电池工作时,正极是____________极(填“a”或 “b”);
②该电池负极反应的离子方程式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
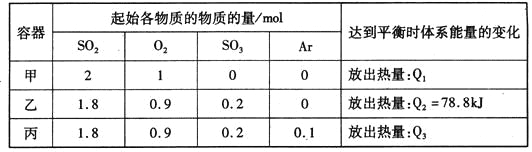
下列叙述正确的是
A. Q1>Q3>Q2=78.8kJ
B. 三个容器中反应的平衡常数均为K=2
C. 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D. 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com