
科目: 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g) △H<0,2SO2(g)+O2(g)
2NH3(g) △H<0,2SO2(g)+O2(g)![]() 2SO3(g) △H<0。请回答下列问题:
2SO3(g) △H<0。请回答下列问题:
(1)从影响化学反应速率和化学平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是_______。实际生产中采取的措施是_________。
(2)在合成氨的工业生产中,要分离出氨,目的是__________;而合成SO3的过程中,则不需要分离出SO3,原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③⑥⑦B.①④⑥⑦C.②③④⑦D.①②④⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
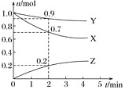
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】根据水解反应离子方程式的书写原则及其注意的问题,判断下列选项正确的是( )
A. FeCl3+3H2O===Fe(OH)3↓+3HCl
B. Al2S3+6H2O![]() 2Al(OH)3+3H2S
2Al(OH)3+3H2S
C. S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D. HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】精细化工在生产和生活中有广泛而重要的应用。
(1)精细化学品往往有特定的功能从而广泛地应用于日常生活中,下列洗涤方法原理各不相同,请比较
①沾有油脂的器皿可用汽油擦洗,其原理是________;
②也可用洗洁精和水洗涤,其原理是_______;
③还可以用纯碱或稀氢氧化钠溶液洗涤,其原理是___________。
④如果水溶液的硬度很大,用肥皂与合成洗涤剂哪个洗涤剂效果更好?为什么? ____。
(2)据报道,我国某地发生误食工业用猪油的中毒事件,原因是工业品包装中混入有机锡等,下列有关叙述正确的是__________。
A.猪油是天然高分子化合物
B.猪油是高级脂肪酸甘油酯
C.猪油发生皂化反应后,反应液能使蓝色石蕊试纸变红
D.猪油皂化反应完全后,反应混合物静置后分为两层
(3)阿司匹林是一种常用的药剂,其化学名称为乙酰水杨酸,其分子结构如图:
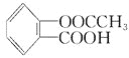
阿司匹林的一种同分异构体中含有苯环和两个羧基,且苯环上只有一个侧链,则阿司匹林的这种同分异构体的结构简式为____________。以苯酚为原料合成水杨酸,为阿司匹林的大量生产开辟了广阔的前景,其生产阿司匹林的流程如下:
![]()
![]()
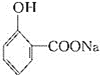
![]() 水杨酸
水杨酸![]() 阿司匹林
阿司匹林
写出反应②的化学方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室合成氨装置如图所示,则以下说法中错误的是( )
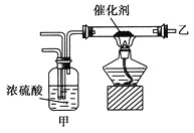
A.装置甲的作用之一是干燥
B.装置甲的作用是化合
C.乙处导出的气体是N2、H2、NH3
D.检验产物可用湿润的红色石蕊试纸或浓盐酸等
查看答案和解析>>
科目: 来源: 题型:
【题目】化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为______________、______________。
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效。请你说明其中的化学原理:________________________。
(4)合成氨是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作?______。
查看答案和解析>>
科目: 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
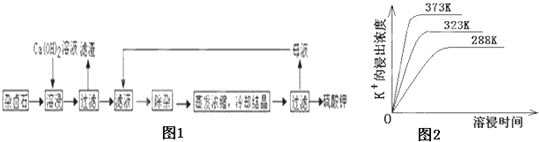
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
科目: 来源: 题型:
【题目】在水溶液中橙色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O![]() 2CrO42-+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
2CrO42-+2H+,重铬酸钾(K2Cr2O7)溶于水配成的稀溶液是橙黄色的。
(1)向上述溶液中加入NaOH溶液,溶液呈___色。因为___。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀硫酸,则溶液呈__色,因为___。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡___(填“向左移动”或“向右移动”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:将Fe3+转化为Fe2+

(1)Fe3+与Cu粉发生反应的离子方程式为__。
(2)探究白色沉淀产生的原因,请填写实验方案:__、__。

查阅资料:
已知:①SCN-的化学性质与I-相似。
②2Cu2++4I-=2CuI↓十I2。
则Cu2+与SCN-反应的离子方程式为__。
实验II:将Fe2+转化为Fe3+
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因:__。
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应I:Fe2+与HNO3反应,
反应II:Fe2+与NO反应。
①依据实验现象,可推知反应I的速率比反应II__(填“快"或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明___。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com