
科目: 来源: 题型:
【题目】下列与实验现象对应的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向浓度为0.1mol/LNaCl、KI混合液中逐滴加入AgNO3溶液 | 出现黄色沉淀 | 溶解性:AgCl>AgI |
B | 溴乙烷与NaOH的乙醇溶液共热,将溢出气体通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 证明有乙烯生成 |
C | 向X的溶液中滴入浓NaOH溶液,将干燥红色石蕊试纸置于管口 | 无明显现象 | X溶液中有NH4+ |
D | 将SO2气体通入Ba(NO3)2溶液 | 产生白色沉淀 | 沉淀为BaSO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v(NH3)=0.05 mol/(Lmin)B.v(NH3)=0.2 mol/(Lmin)
C.v(H2)=0.3 mol/(Lmin)D.v(H2)=0.4 mol/(Lmin)
查看答案和解析>>
科目: 来源: 题型:
【题目】维生素C是广泛存在于新鲜水果蔬菜及许多生物中的一种重要的维生素,作为一种高活性物质,它参与许多新陈代谢过程。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
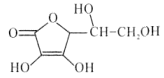 +I2
+I2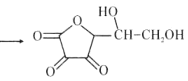 +2HI
+2HI
下列说法正确的是( )
A.上述反应说明维生素C能使碘水褪色,该反应的反应类型为取代反应
B.维生素C可发生取代反应、加成反应、氧化反应
C.维生素C可以水解得到2种产物
D.维生素C不可溶于水,可以溶于有机溶剂
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. H2的燃烧热为285.8 kJ/mol,则表示H2燃烧热的热化学方程式为:H2(g)+1/2O2(g)=H2O(g) ΔH=-285.8 kJ/mol
D. 碳酸钙的溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,已知醋酸的电离常数Ka=1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)=3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c(H+)>c(OH-)
B. 将相同浓度的CH3COOH溶液与CH3COO Na溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg沉淀生成
查看答案和解析>>
科目: 来源: 题型:
【题目】我国黄铜矿的储量比较丰富,主要产地集中在长江中下游地区、川滇地区、山西南部、甘肃的河西走廊以及西藏高原等地。黄铜矿是一种铜铁硫化物矿物,外观黄铜色,主要成分是CuFeS2,还含有少量的SiO2和Ni、Pb、Ag、Au等元素。为实现黄铜矿的综合利用,设计了如下的工艺流程。
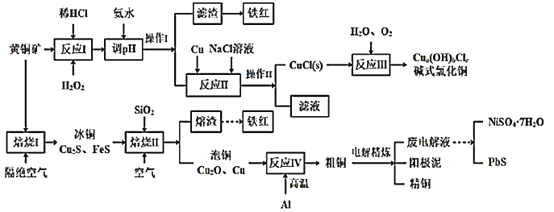
已知:①a、b、c均为整数;②CuCl+2Cl-![]() CuCl32-。
CuCl32-。
(1)CuFeS2中S的化合价为___。铁红的主要成分是___(填化学式)。
(2)实验测得“反应I”中有SO42-生成,该反应离子方程式为___,选H2O2溶液优于HNO3的原因是___。
(3)“反应II”中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(4)写出“焙烧I”发生反应的化学方程式___。
(5)废电解液中含有少量的Pb2+,从废电解液中除去Pb2+的方法是往其中通人H2S至饱和,使Pb2+转化为硫化物沉淀,若废电解液的pH=4,为保证不生成NiS沉淀,Ni2+浓度应控制在___以下。(已知:饱和H2S溶液中c(H2S)为0.1mol/L,H2S的电离常数Ka1=1.0×10-7,Ka2=2.0×10-15,Ksp(NiS)=1.4×10-16)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】扁桃酸是唯一具有脂溶性的果酸,实验室用如下原理制备:
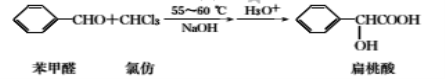
合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、 氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:
步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。

步骤二:将反应液用200mL水稀释,每次用20mL。乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。
请回答下列问题:
(1)图中仪器C的名称是___。
(2)装置B的作用是___。
(3)步骤一中合适的加热方式是___。
(4)步骤二中用乙醚的目的是___。
(5)步骤三中用乙醚的目的是___;加入适量无水硫酸钠的目的是___。
(6)该实验的产率为___(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用NaOH溶液来滴定邻苯二甲酸氢钾溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_____________________________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是______________。
(2)选用指示剂是______________,滴定终点现象______________________________________。
(3)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
滴定次数实验数据 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是_______________。
(4)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的产量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b。
③常温下,AgCl在同物质的量浓度的氨水和NaCl溶液中的溶解度比较,前者大。
④若将适量CO2通入0.1 mol/LNa2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32-)+ c(HCO3ˉ)= 0.1 mol/L
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
A.①②④⑤B.②④⑤C.②⑤D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com