
科目: 来源: 题型:
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与
与![]() 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
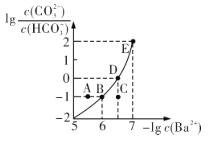
A.该溶液中![]()
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾在化工医药、水处理等很多方面有重要应用,可以用电解法制备,装置如图所示。直流电源采用乙烷一空气的碱性燃料电池。下列说法正确的是
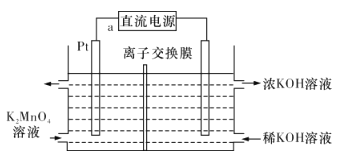
(已知电流效率η=![]() ×100%)
×100%)
A.电源负极的电极反应式为C2H6- 14e- +6H2O=2CO32-+ 18H+
B.该离子交换膜为阴离子交换膜
C.a极为直流电源的负极
D.若消耗0. 02 mol O2,产生0.055 mol KMnO4,则η=68.75%
查看答案和解析>>
科目: 来源: 题型:
【题目】实验测得浓度均为0.5 mol. L-1的Pb(CH3COO)2溶液的导电性明显弱于Pb(NO3)2溶液,又知PbS是不溶于水及稀酸的黑色沉淀,下列离子方程式书写错误的是
A.Pb(NO3)2溶液与CH3COONa溶液混合:Pb2+ +2CH3COO-=Pb(CH3COO)2
B.Pb(NO3)2溶液与K2S溶液混合:Pb2++S2-=PbS↓
C.Pb(CH3COO)2溶液与K2S溶液混合:Pb(CH3COO)2+S2- =PbS↓+ 2CH3COO-
D.Pb(CH3COO)2在水中电离: Pb(CH3COO)2=Pb2+ +2CH3COO-
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、 Al2O3、FeO、CaO、SiO2 )为原料,制取醋酸镍的工艺流程图如下:
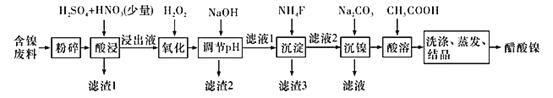
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时的溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(1)粉碎含镍废料的作用是__________。
(2)酸浸过程中,1molNiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_____________。
(3)写出氧化步骤中加入H2O2发生反应的离子方程式:________。
(4)调节pH除铁、铝步骤中,溶液pH的调节范围是________。
(5)滤渣3主要成分的化学式是_________。
(6)沉镍过程中,若c(Ni2+ )=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5 mol·L-1],则需要加入Na2CO3固体的质量最少为___________g(保留1位小数)。
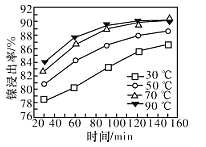
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为______℃、_______min。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用软锰矿制备高锰酸钾,主要实验步骤如下:
步骤一:将软锰矿(主要成分为MnO2)、KClO3和KOH固体按一定比例混合后加热熔融可制得绿色K2MnO4;
步骤二:将反应后固体充分溶解、过滤,向滤液中通入过量CO2气体使溶液显酸性,K2MnO4在酸性条件下反应得到KMnO4、MnO2和K2CO3,最后分离得到高锰酸钾晶体(粗产品)。
请回答下列问题:
(1)步骤一加热熔融应在________(填序号)进行。
A.铁坩埚 B.氧化铝坩埚 C.瓷坩埚 D.石英
(2)为进一步提高粗产品(高锰酸钾晶体)的纯度,常采用的实验方法是_____________。
(3)KMnO4、MnO2在一定条件下都可以氧化浓盐酸制取氯气,制取等物质的量的氯气消耗KMnO4与MnO2的物质的量之比为________________。
(4)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡),记录的现象如表:
滴入KMnO4溶液的次序(假设每滴溶液体积相等) | 滴入的KMnO4溶液紫色褪去的时间 |
先滴入第1滴 | 1min |
褪色后再滴入第2滴 | 15s |
褪色后再滴入第3滴 | 3s |
褪色后再滴入第4滴 | 1s |
请分析高锰酸钾溶液褪色时间变化的原因:_________。
(5)我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。我校某同学通过查阅资料,拟采用如下方法测定2019年暑假新装修的焕然一新的明德楼教室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O。
实验操作:用容积为1000mL用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如图),当酸性高锰酸钾溶液正好褪色时,停止注入。

①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液l000mL,需0.1000mol/L的酸性KMnO4溶液的体积为___________。
②装置中多孔玻璃球泡的作用是__________。
③该同学在206教室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第250次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液恰好褪色。请通过计算判断,该教室空气中甲醛含量________(填“已”或“未”)超标。若未超标,该教室内空气中甲醛(HCHO)含量为________mg/m3;若已超标,请举出减少室内空气污染的一条合理措施:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯是重要的基础化工原料,下图是大学化学教材《有机化学基础》上由甲苯合成J的一种合成路线。
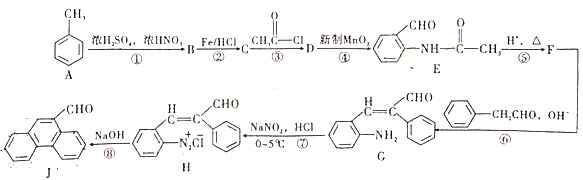
请依据上述流程回答以下问题
(1)B的化学名称为___________,J的分子式为___________。
(2)D生成E的反应类型为___________。
(3)设计第③步和第⑤步的目的是______________。
(4)由H生成J过程中生成的无机物除了![]() 外还有_________。
外还有_________。
(5)写出C→D的反应方程式为_______。
(6)D的同分异构体有多种。其中含有苯环和碳氧双键,且核磁共振氢谱有四组峰的有_________种。(不考虑立体异构)
(7)请依据流程图中相关信息,写出由甲苯和乙醛制备![]() 的合成路线________。(无机试剂任选)
的合成路线________。(无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】本题涉及部分铜及其化合物的相关结构问题的考查,请回答下列问题。
(1)写出基态Cu2+的核外电子排布式:________。Cu的同周期元素中,与铜原子最外层电子数相等的元素原子还有___________(用元素符号表示)。
(2)从原子结构角度分析高温Cu2O比CuO稳定的原因是___________。
(3)[Cu(NH3)2]Ac可用于合成氨工业中的铜洗工序,除去进人合成塔前混合气中的CO(CO能使催化剂中毒)。
①Ac表示CH3COO-,Ac中碳原子的杂化方式为________。
②[Cu(NH3)2]Ac能够结合CO的原因是________。
(4)铜原子与氯原子形成化合物的晶胞如图所示(黑球代表铜原子,白球表示氯原子)。
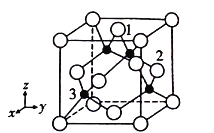
①已知铜和氯的电负性分别为1.9和3.0,则铜与氯形成的化合物属于________填(“离子”或“共价”)化合物。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1的坐标为(![]() ,
,![]() ,1),则原子2和3的坐标分别为___________、__________。
,1),则原子2和3的坐标分别为___________、__________。
③已知该晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则该晶体中铜原子和氯原子的最短距离为_____________pm(只写计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷在工农业生产、生活中有着重要作用,请回答下列问题。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)H1=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)H2
若在相同条件下,1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则H2=_________。
(2)用CH4催化还原NO,欲提高N2的平衡产率,应该采取的措施是_______(填序号)。
A.升高温度 B.增大压强 C.降低温度 D.降低压强
(3)一定温度下,在初始体积为2L恒压密闭容器中通入1molCH4和4molNO(假设只发生反应②),20min后该反应达到平衡,测得容器中N2的物质的量为0.8mol。则从反应开始至刚达到平衡用NO表示的反应速率v(NO)=________________,该温度下反应的平衡常数K=_______________。(答案可用分数表示)
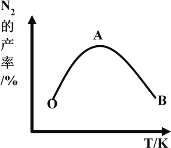
(4)为了提高CH4和NO转化为N2的产率,种学家寻找了一种新型的催化剂。将CH4和NO按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得N2的产率与温度的关系如图所示,OA段N2产率增大的原因是_________。
(5)对于反应②而言,不同温度下,CH4的浓度变化如图所示,下列说法正确的是__________(填序号)。
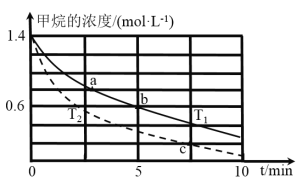
A.T1大于T2
B.c时二氧化碳的浓度为0.2mol/L
C.a点正反应速率大于b点的逆反应速率
D.a点的反应速率一定比c点的反应速率小
(6)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液,该甲烷燃料电池中,负极反应方程式为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,氯气与NaOH溶液反应可生成NaCl、NaClO和NaClO3。下列判断不正确的是( )
A.若反应过程中消耗2mol氯气,则转移电子数目可能为3NA
B.反应停止后n(NaClO):n(NaCl):n(NaClO3)可能为1:6:1
C.氯气与氢氧化钠反应过程中消耗氯气与NaOH的物质的量之比一定为1:2
D.若氢氧化钠与氯气恰好完全反应,则反应后所得溶液中总是存在:c(Na+)=c(Cl-)+c(ClO-)+c(ClO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com