
科目: 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226kJ/mol
O2(g) ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
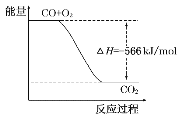
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH=-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:![]() 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 、
、![]() 、
、![]() 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】反应mA(g)+nB(g)![]() cC(g)+dD(g)达平衡后,缩小体积变为原来一半,当反应再次平衡时,A的浓度变为原平衡时的1.5倍,则下列说法正确的是( )
cC(g)+dD(g)达平衡后,缩小体积变为原来一半,当反应再次平衡时,A的浓度变为原平衡时的1.5倍,则下列说法正确的是( )
A.m+n<c+dB.B物质的转化率减小C.平衡常数K增大D.该平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
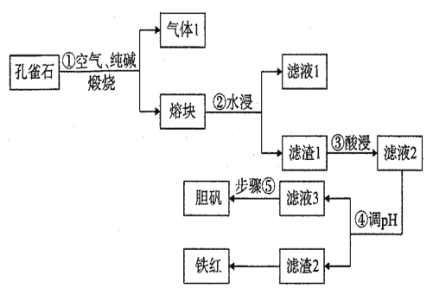
(1)气体1的成分除H2O(g)外,还有CO2、SO2,写出步骤①中发生氧化还原反应的化学方程式为 _______________,若反应生成1mol SO2,则反应中转移的电子数为___________mol。滤液1的主要成分为__________(写化学式)
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有_________________(答出两点)。
(3)步骤④调pH所用试剂为_____________ (写化学式)
(4)常温下滤液3的pH=4,Ksp[Fe(OH) 3]=4×10-38,则滤液3中c(Fe3+)=___________。
(5)步骤⑤操作为_______________________________________________________.。
(6)假设使用孔雀石矿石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则:
①铁红的用途之一为________,
②孔雀石矿石中铁元素的含量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器中充有2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g)。当反应进行到4min时,测得此时SO2为0.4mol,则2min时密闭容器中SO3的物质的量为( )
2SO3(g)。当反应进行到4min时,测得此时SO2为0.4mol,则2min时密闭容器中SO3的物质的量为( )
A.1.6molB.1.2molC.大于1.6molD.小于1.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ·mol-1、285.8kJ·mol-1、890.3kJ·mol-1、2800kJ·mol-1,则下列热化学方程式正确的( )
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ·mol-1
O2(g)=CO(g) ΔH=-393.5kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=+571.6kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】辉铜矿与铜蓝矿都是天然含硫铜矿,在地壳中二者常伴生存在。现取一份该伴生矿样品,经检测后确定仅含Cu2S、CuS和惰性杂质。为进一步确定其中Cu2S、CuS的含量,某同学进行了如下实验:
①取2.6g样品,加入200.0mL0.2000mol·L-1酸性KMnO4溶液,加热(硫元素全部转化为SO42-),滤去不溶杂质;
②收集滤液至250mL容量瓶中,定容;
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定,消耗20.00mL;
④加入适量NH4HF2溶液(掩蔽Fe3+和Mn2+,使其不再参与其他反应),再加入过量KI固体,轻摇使之溶解并发生反应:2Cu2++4I-=2CuI+I2;
⑤加入2滴淀粉溶液,用0.1000mo1·L-1Na2S2O3溶液滴定,消耗30.00mL(已知:2S2O32-+I2=S4O62-+2I-)。
回答下列问题:
(1)写出Cu2S溶于酸性KMnO4溶液的离子方程式:___________;
(2)配制0.1000mol· L-1FeSO4溶液时要用煮沸过的稀硫酸,原因是___________,配制过程中所需玻璃仪器除了烧杯、玻璃棒、容量瓶外还有___________;
(3)③中取25.00mL待测溶液所用的仪器是___________;
(4)⑤中滴定至终点时的现象为___________;
(5)混合样品中Cu2S和CuS的含量分别为_________%、_________%(结果均保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是( )
A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _57.4 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①H2(g)+ ![]() O2(g)=H2O(g);ΔH1= akJ·mol-1
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+ ![]() O2(g)=H2O(l);ΔH3= c kJ·mol-1
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0B.b>d>0C.a<c<0D.2c=d>0
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com