
科目: 来源: 题型:
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________________;并用简单的装置图来表明你所阐述的理由______________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有_______________;
(3)下列物质的加入能减慢氢气生成速率但不影响生成氢气的体积的是_____
A.加入碳酸钠溶液 B.加入硫酸钠溶液
C.加入硝酸钠溶液 D.加入醋酸钠溶液
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验 | 1 | 2 | 3 | 4 | 5 | 6 |
4mol·mol-1H2SO4/mL | 40 | V1 | V2 | V3 | V4 | V5 |
饱和 CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V6、V8 分别是_____________;
②该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会大大提高,随着加入的 CuSO4 溶液增多时,生成氢气的速率会______(填加快、减慢或不变)。理由___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近的研究发现,复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,因而受到许多发达国家的青睐。MnFe2O4的制备流程如下:

(1)原料Fe(NO3)n中n=______,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为______。
(2)步骤二中“连续搅拌”的目的是______;步骤三中洗涤干净的标准是______。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:MnFe2O4![]() MnFe2O4﹣x+
MnFe2O4﹣x+![]() O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
O2↑、MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑。请认真分析上述两个反应并回答下列问题:
①若MnFe2O4﹣x中x=0.6,则MnFe2O4﹣x中Fe2+占全部铁元素的百分率为______。
②该热化学循环制氢法的优点有______(答两点即可)。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下:
 △H=+88.6kJ/mol
△H=+88.6kJ/mol
则M与N相比,较稳定的是____。
(2)已知CH3OH⑴的燃烧热为726.5kJ·mol-1,CH3OH(l) + l/2O2(g)=CO2(g)+2H2(g)
△H=-akJ·mol-1,则a_______726.5 (填“>”、“<”或 “=”)
(3)将Cl2和H2O(g)通过灼热的木炭层,生成HCl和CO2。当有1mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:______________________ 。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料, 4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) △H=-1176kJ·mol-1,则27g铝粉完全反应放出的热量为_____________。
(5)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H=+489.0 kJ mol-1
CO(g)+l/2O2(g)=CO2(g) △H=-283. 0kJ mol-1
C (石墨)+O2(g)=CO2(g) △H=-393.5kJ mol-1
则4Fe (s)+3O2(g) =2Fe2O3 (s) △H=____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A(C2H4)是基本的有机化工原料。用A和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知: +
+![]() →2ROH+
→2ROH+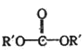
回答下列问题:
(1) B的分子式是__________ 。若D为单取代芳香族化合物且能与金属钠反应;每个D分子中只含有1个氧原子, D中氧元素的质量分数约为13.1%,则D的结构简式为__________。
(2) C中含有的官能团名称是_______________。⑥的反应类型是________________。
(3)据报道,反应⑦在微波辐射下,以NaHSO4·H2O为催化剂进行,请写出此反应的化学方程式:___________________________________________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:______________________。
i .含有苯环和![]() 结构 ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
结构 ii.核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色的E的所有同分异构体共有(不考虑立体异构)__________种。
(6)参照 的合成路线,写出由2-氯丙烷和必要的溶剂、无机试剂制备
的合成路线,写出由2-氯丙烷和必要的溶剂、无机试剂制备 的合成流程图:_____________________________。
的合成流程图:_____________________________。
合成流程图示例如下:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
Cl2+2OH-![]() Cl-+ClO-+H2O
Cl-+ClO-+H2O
3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O
5Cl-+ClO3-+3H2O
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:
①多用滴管中装有5 mL浓盐酸;②微型具支试管中装有1.5 g KMnO4;③微型具支试管中装有2~3 mL浓硫酸;④U形反应管中装有30% KOH溶液;⑤U形反应管中装有2 mol·L-1 NaOH溶液;⑥、⑦双U形反应管中分别装有0.1 mol·L-1 KI-淀粉溶液和KBr溶液;⑧尾气出口用浸有0.5 mol·L-1 Na2S2O3溶液的棉花轻轻覆盖住
(1)检查整套装置气密性的方法是________。
(2)为了使装置④⑤中的反应顺利完成,应该控制的反应条件分别为___________。
(3)装置⑥⑦中能够观察到的实验现象分别是_________。
(4)如果把装置⑥⑦中的试剂互换位置,则______(填“能”或“不能”)证明氧化性Cl2>I2,理由是_______。

(5)已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置④所得溶液中提取氯酸钾晶体的实验操作是______________。
(6)尾气处理时Cl2发生反应的离子方程式为_________。
(7)选择微型实验装置的优点有___________(任答两点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常利用CO2为初始反应物,合成一系列重要的化工原料。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)=NH2COONH4(s)ΔH1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.49 kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=-86.98 kJ·mol-1
请回答下列问题:
①反应Ⅰ的ΔH1=______________。
②在________(填“高温”或“低温”)情况下有利于反应Ⅱ的自发进行。
③一定温度下,在体积固定的密闭容器中按n(NH3)∶n(CO2)=2∶1 进行反应Ⅰ。下列能说明反应Ⅰ达到了平衡状态的是____________(填字母代号)。
A 混合气体的平均相对分子质量不再变化
B 容器内气体总压强不再变化
C NH3与CO2的转化率相等
D 容器内混合气体的密度不再变化
(2)将CO2和H2按质量比25∶3充入一定体积的密闭容器中,在不同温度下发生反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CH3OH(g)的物质的量随时间的变化如下图所示。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K(Ⅰ)______(填“>”“<”或“=”)K(Ⅱ)。
②欲提高CH3OH(g)的平衡产率,可采取的措施除改变温度外,还有__________(任写两种)。
③一定温度下,在容积均为2 L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡。
容器 | 甲 | 乙 |
反应物起 始投入量 | 1 mol CO2、 3 mol H2 | a mol CO2 b mol H2 c mol CH3OH(g) c mol H2O(g) (a,b,c均不为0) |
若甲容器中反应达平衡后气体的压强为开始时的![]() ,则该温度下,反应的平衡常数为______;要使反应达平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_______________。
,则该温度下,反应的平衡常数为______;要使反应达平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为10L的密闭容器中,进行如下反应:A(g)+2B(g)![]() C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图1.
C(g)+D(g),最初加入1.0mol A和2.2mol B,在不同温度下,D的物质的量n(D)和时间t的关系如图1.

试回答下列问题:
(1)800℃时,0~5min内,以B表示的平均反应速率为 .
(2)能判断反应达到化学平衡状态的依据是 (填字母).
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(3)若最初加入1.0mol A和2.2mol B,利用图中数据计算800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”).
(4)700℃时,某时刻测得体系中物质的量浓度如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).
(5)在催化剂作用下,CO可用于合成甲醇:CO(g)+2H2(g)CH3OH(g)若在恒温恒压的条件下,向密闭容器中充入4mol CO和8mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:

①该反应的正反应属于__________反应;(填“吸热”或“放热”).
②在0.1Mpa、100℃的条件下,该反应达到平衡时容器内气体的物质的量为 mol。
若在恒温恒容的条件下,向上述平衡体系中充入4mol CO,8mol H2,与原平衡状态相比,达到平衡时CO转化率 (填“增大”,“不变”或“减小”),平衡常数K (填“增大”,“不变”或“减小”).
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸的电离方程式为![]()
![]()
![]() +H+,其Ka=6.25×10-5,苯甲酸钠(
+H+,其Ka=6.25×10-5,苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,H2CO3的Ka1=4.17×l0-7,Ka2=4.90×l0-11。在生产碳酸饮料的过程中,除了添加NaA外, 还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,H2CO3的Ka1=4.17×l0-7,Ka2=4.90×l0-11。在生产碳酸饮料的过程中,除了添加NaA外, 还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
A. H2CO3的电离方程式为 H2CO3![]() 2H++CO32-
2H++CO32-
B. 提高CO2充气压力,饮料中c(A-)不变
C. 当pH为5.0时,饮料中 =0.16
=0.16
D. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g) ![]() 2Z(g),有关下列图像说法正确的是
2Z(g),有关下列图像说法正确的是
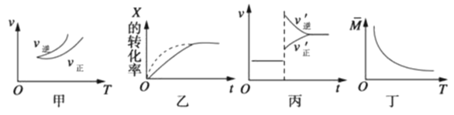
A.依据图甲可判断正反应为吸热反应
B.在图乙中,虚线可表示压强增大
C.若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com