
科目: 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体,难溶于CCl4。实验室可将干燥二氧化碳和干燥氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
回答下列问题:
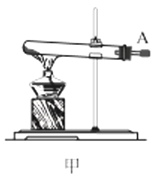
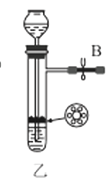

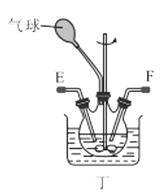
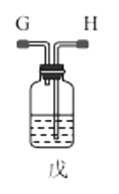
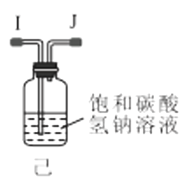
(1)利用装置甲制备氨气的化学方程式为__。
(2)简述检查装置乙气密性的操作__。
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→__→__→EF←__←A。
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为__(填“热水浴”或“冷水浴”);丁中气球的作用是__。
(5)从装置丁的混合物中分离出产品的方法是__(填写操作名称)。
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为__(已知:Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100。计算结果保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是以煤炭为主要能源的发展中国家,煤炭燃烧产生的烟气中含有大量的NOx和SO2,带来了严重的大气污染。某化工小组进行了ClO2协同氨水法脱除模拟烟气中NOx和SO2的实验研究,其流程如图:
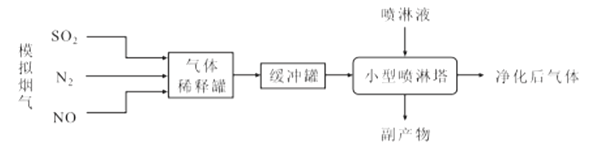
回答下列问题:
(1)制备“模拟烟气”时应首先向装置管道内通入__,目的是__。
(2)“喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为__,还可将葡萄糖替换为__(填字母标号)。
A.FeCl3溶液 B.SO3 C.甲醇 D.酸性KMnO4溶液
(3)利用ClO2协同氨水进行脱硫脱硝净化时,污染性气体脱除效率变化情况如图所示,则该脱除技术的最佳温度应为__℃,喷淋塔中可能产生的一种副产物的化学式为__,该物质的常见用途是__。

(4)传统湿式氨法烟气处理技术以尿素[CO(NH2)2]热水解产生的NH3溶于水为喷淋液。在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成,该反应的化学方程式为__。
(5)该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,吸收液循环量cL/h,通过离子色谱测定脱除前后吸收液中主要离子浓度如下表所示,则NO的脱除率为__(用含有a、b、c的代数式表示)。
离子种类 浓度数据 | ClO2 (mg/L) | Cl- (mg/L) | SO42- (mg/L) | SO32- (mg/L) | NO3- (mg/L) | NO2- (mg/L) |
吸收前 | 150 | 43.54 | —— | —— | —— | —— |
吸收后 | 12.62 | 110.49 | 213.64 | —— | 62.00 | —— |
反应前后差值 | 137.38 | 66.95 | 213.64 | —— | 62.00 | —— |
注:“——”表示该离子低于检测极限,可以认为不存在。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为__。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的__区。
(3)实验室常用KSCN溶液、苯酚(![]() )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为__(用元素符号表示),苯酚中碳原子的杂化轨道类型为__。
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为__(用元素符号表示),苯酚中碳原子的杂化轨道类型为__。
(4)铁元素能与CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含__molσ键,与CO互为等电子体的一种离子的化学式为__。
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的__空隙和__空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B(![]() ,0,
,0,![]() ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为__。
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为__。
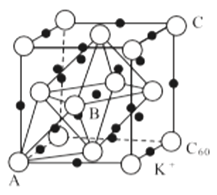
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为__,晶胞参数为428pm,则晶体密度为__g/cm3(NA表示阿伏伽德罗常数的值,列出表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】三甲胺N(CH3)3是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N—二甲基甲酰胺(N(CH3)2NCHO,简称DMF)转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
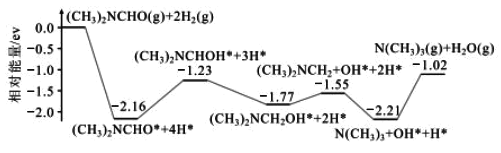
该历程中最大能垒(活化能)=__eV,该步骤的化学方程式为__。
(2)该反应变化的ΔH__0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为__。
(3)160℃时,将DMF(g)和H2(g)以物质的量之比为1:2充入盛有催化剂的刚性容器中,容器内起始压强为p0,达到平衡时DMF的转化率为25%,则该反应的平衡常数Kp=__(Kp为以分压表示的平衡常数);能够增大DMF平衡转化率同时加快反应速率的操作是__。
(4)三甲胺是鱼腥臭的主要来源,是判断海水鱼类鲜度的化学指标之一。通过传感器产生的电流强度可以监测水产品中三甲胺的含量,一种燃料电池型三甲胺气体传感器的原理如图所示。外电路的电流方向为__(填“a→b”或“b→a”),负极的电极反应式为__。

查看答案和解析>>
科目: 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均不超过20。W、X、Y最外层电子数之和为15,![]() 是实验室常用的一种化学试剂。下列说法中错误的是( )
是实验室常用的一种化学试剂。下列说法中错误的是( )
A.Z2Y的水溶液呈碱性
B.最简单氢化物沸点高低为:X>W
C.常见单质的氧化性强弱为:W>Y
D.![]() 中各原子最外层均满足8电子稳定结构
中各原子最外层均满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】电解法转化CO2可实现CO2资源化利用。电解CO2制甲酸盐的装置如图所示。下列说法中错误的是( )
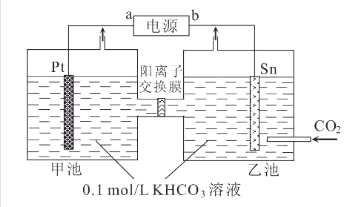
A.b是电源负极
B.K+由乙池向甲池迁移
C.乙池电极反应式为:CO2+HCO3-+2e-=HCOO-+CO32-
D.两池中KHCO3溶液浓度均降低
查看答案和解析>>
科目: 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
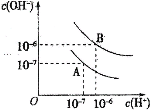
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为______________。
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________。
(3)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=_________,实验②所得溶液中由水电离产生的c(OH-)=______。
(4)95℃时,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·/span>L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.l mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显_____(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后反应的化学方程式_______________________。所得溶液显______(填“酸”、“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为________(混合时,忽略溶液体积的变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】若用AG表示溶液的酸度,AG的定义为AG=lg![]() 。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
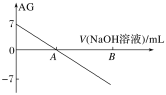
A.室温下,醋酸的电离常数约为10-5
B.A点时加入氢氧化钠溶液的体积为20.00 mL
C.若B点为40 mL,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从A到B,水的电离程度逐渐变大
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向一定体积0.1mol·L-1的氨水中逐渐加入等浓度的盐酸,溶液中pOH [pOH=-lgc(OH-)]与pH的变化关系如下图所示.下列说法不正确是
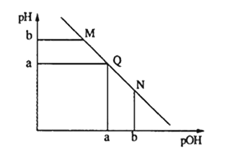
A. M点和N点溶液中H2O的电离程度相同
B. Q点溶液中,c(NH4+)+c(NH3·H2O)=c(Cl-)
C. M点溶液的导电性小于Q点溶液的导电性
D. N点溶液加水稀释,![]() 变小
变小
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,体积均为25.00mL,浓度均为0.0100mol/L的HA、H3B溶液分别用0.0100mol/LNaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法中正确的是( )
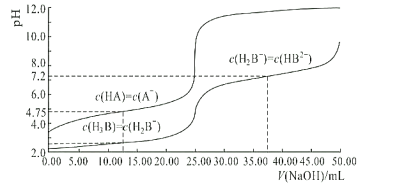
A.NaOH溶液滴定HA溶液可选甲基橙作指示剂
B.均为0.0100mol/LHA、H3B溶液中,酸性较强的是HA
C.25℃时,0.0100mol/LNa2HB溶液的pH>7
D.25℃时,H2B-离子的水解常数的数量级为10-3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com