
科目: 来源: 题型:
【题目】周期表中的五种元素A、B、D、E、F,原子序数依次增大,A的基态原子价层电子排布为nsnnpn;B的基态原子2p能级有3个单电子;D是一种富集在海水中的元素,含量位于海水中各元素的第三位;E2+的3d轨道中有10个电子;F位于第六周期,与Cu同族,其单质在金属活动性顺序表中排在末位。
(1)写出E的基态原子的价层电子排布式___________。
(2)A、B形成的AB﹣常作为配位化合物中的配体,其A原子的杂化方式为________,AB﹣中含有的σ键与π键的数目之比为________。
(3)FD3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体F2D6的形式存在,依据以上信息判断FD3,晶体的结构属于____晶体,写出F2D6的结构式________。
(4)E、F均能与AB﹣形成配离子,已知E与AB﹣形成的配离子为正四面体形。F(+1价)与AB形成的配离子为直线形,工业上常用F和AB﹣形成的配离子与E反应来提取F单质,写出E置换F的离子方程式_________________。
(5)F单质的晶体为面心立方最密堆积,若F的原子半径为a nm,F单质的摩尔的的质量为Mg/mol,阿伏加德罗常数为NA,求F单质的密度为______g/cm3。(用a、NA、M的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W为元素周期表前四周期的元素。其中X为形成的化合物中种类最多的元素,Y的内层电子数是最外层电子数的9倍,Z在元素周期表的各元素中电负性最大,W元素的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题.

(1)W元素在元素周期表中的位置为____________________________。
(2)比较XZ4和YZ2的熔沸点大小并说明理由________________________。
(3)W2+能与氨气分子形成配离子[W(NH3)4]2+。写出该配离子的结构简式(标明配位键)__。
(4)X能与氢、氮,氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为__,1mol分子中σ键的数目为__,该物质易溶水的主要原因是_______________________。
(5)X的某种晶体为层状结构,可与熔融金属钾作用、钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式时表示为_________。
(6)元素Y与元素Z形成的晶体结构如图②所示,晶胞中Y离子的配位数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是 ,铜的基态原子核外电子排布式为 ,元素铁与铜的第二电离能分别为:ICu=1958 kJ·mol-1、IFe=1561 kJ·mol-1,ICu比IFe大得多的原因是 。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
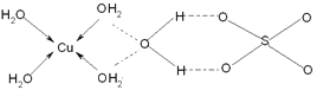
图中虚线表示_____________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
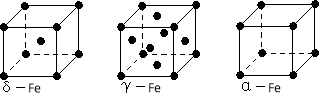
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为 。
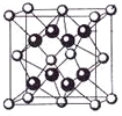
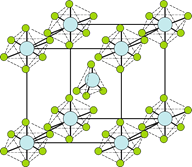
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_______________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为 。
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
磷元素在生产和生活中有广泛的应用。
(1)P原子价电子排布图为__________________________。
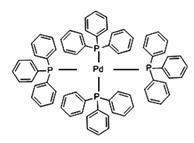
(2)四(三苯基膦)钯分子结构如下图:
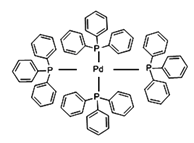
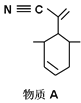
P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为___________;判断该物质在水中溶解度并加以解释_______________________。该物质可用于右上图所示物质A的合成:物质A中碳原子杂化轨道类型为__________________;一个A分子中手性碳原子数目为__________________。
(3)在图示中表示出四(三苯基膦)钯分子中配位键:_____________
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正六面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为_____________________;正四面体形阳离子中键角小于PCl3的键角原因为__________________;该晶体的晶胞如右图所示,立方体的晶胞边长为a pm,NA为阿伏伽德罗常数的值,则该晶体的密度为_______g/cm3。
(5)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
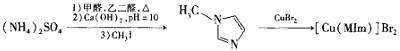
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与![]() 互为等电子体的阴离子为_______。
互为等电子体的阴离子为_______。
(3)![]() 中心原子的杂化方式为_________。
中心原子的杂化方式为_________。
(4)MIm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如图所示。
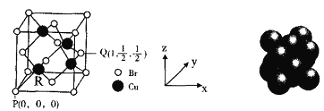
由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。
(6)Cu晶体的堆积方式为面心立方最密堆积,设Cu原子半径为a,晶体中Cu原子的配位数为________,晶体的空间利用率为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钽是一种过渡金属,钽酸锂(LiTaO3)可用于制作滤波器。一种制备钽酸锂的流程如下:回答下列问题:

(1)LiTaO3中钽的化合价为___。
(2)同体A呈红色,其主要成分是___(写化学式),常见用途有___(填一种即可)。
(3)操作2的名称是___,用来检验溶液B中阴离子的常用试剂是___。
(4)HTaO3是___(填字母)。
a.难溶的强酸 b.可溶的弱酸 c.可溶的强酸 d.难溶的弱酸
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为___。
(6)上述废料中含Ta2O5的质量分数为44.2%,杂质不含Ta元素。现有100kg该废料,按上述流程最多可制备___kgLiTaO3。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫氰化钾可用于农药、医药、电镀、化学试剂、检定铁离子、铜和银等。某兴趣小组同学在实验室模拟工业制备硫氰化钾(KSCN),实验装置如图所示。
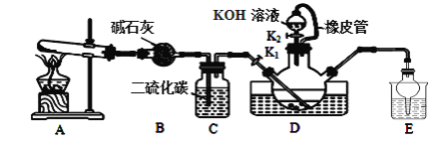
实验步骤如下:
(1)制备NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2。
NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2。
①实验前,应进行的操作是__;三颈烧瓶内盛放有一定量的CS2、水和催化剂。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是__。
②实验开始时打开K1,加热装置A、D,缓慢地向装置D中充入气体。装置A中发生反应的化学方程式是__,装置C的作用可能是__。
(2)制备KSCN溶液:移去装置A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是__。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,___,得到硫氰化钾晶体。
(4)测定KSCN的含量:称取10.00g样品配成1000mL溶液,量取25.00mL溶液于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000mol·L-1AgNO3标准溶液滴定。经过3次平行试验,达到滴定终点时,消耗AgNO3标准溶液的体积平均为20.00mL。滴定反应的离子方程式为SCN-+Ag+=AgSCN↓。
①判断达到滴定终点的方法是__。
②样品中KSCN的质量分数为__(KSCN的摩尔质量为97g·mol-1,保留4位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2是一种橙黄色的液体,遇水剧烈反应,并产生能使品红褪色的气体。下列说法错误的是

A. S2Cl2的分子中的两个S原子均是sp3杂化
B. S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2
C. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O = SO2↑+3S↓+4HCl
D. S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是:
①非极性分子中一定含有非极性键;
②S-Sσ键与s-pσ键的电子云形状相同;
③含有π键的化合物与只含σ键的化合物的化学性质不同;
④冰中存在极性共价键和氢键两种化学键的作用
⑤Cu(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中
⑥氨水中大部分NH3与H2O以氢键(用“…”表示)结合成NH3·H2O分子,根据氨水的性质可知NH3·H2O的结构式为![]()
A. ①③⑥ B. ①②⑤ C. ③⑤⑥ D. ②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com