
科目: 来源: 题型:
【题目】玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜___________加入甲醛,且反应釜应装有________________装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃由石英砂、___________和石灰石(或长石)高温熔融而成,主要反应的化学方程式为______________。
(3)玻璃钢中玻璃纤维的作用是____________。玻璃钢具有__________等优异性能(写出两点即可)
(4)下列处理废旧热固性酚醛塑料的做法合理的是_____________
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂
查看答案和解析>>
科目: 来源: 题型:
【题目】5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:

(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取,①分离出甲醇的操作是的______;②萃取用到的分液漏斗使用前需__________________并洗净,分液时有机层在分液漏斗的________填(“上”或“下”)层;
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤.用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是______;
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母);
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤.为了防止倒吸,减压过滤完成后应先________________,再______。
查看答案和解析>>
科目: 来源: 题型:
【题目】热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是
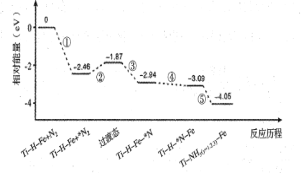
A.①为N![]() N的断裂过程
N的断裂过程
B.① ③在高温区发生,②④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】美国马丁·卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖。他们模拟出了1, 6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示。下列说法正确的是 ( )
![]()
A. 该有机物属于芳香烃,与苯互为同系物
B. 该有机物的分子式为C18H18
C. 1 mol该有机物在常温下最多能与9 mol Br2发生加成反应
D. 该有机物可以发生氧化反应、取代反应、加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是
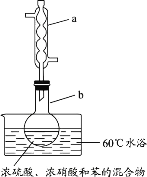
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电泡等。可由电镀废渣(除镍元素外,还含有Cu、Zn、Fe、Cr等元素杂质)为原料获得。工艺流程如下:
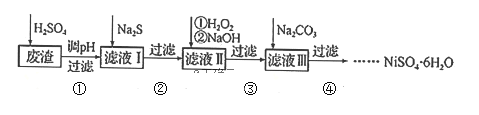
已知:①![]() 是一种不溶于水易溶于强酸的沉淀;②已知
是一种不溶于水易溶于强酸的沉淀;②已知![]() ,
,![]() 的
的![]() 。
。
(1)Ni的原子序数为28,则它在周期表中的位置为______,写出H2O2的结构式______。
(2)步骤②,向滤液I中加入适量![]() 溶液的目的是除去Cu2+和
溶液的目的是除去Cu2+和![]() ,其中除去Cu2+的离子方程式为______;加
,其中除去Cu2+的离子方程式为______;加![]() 之前需控制pH不能太低的目的是______。
之前需控制pH不能太低的目的是______。
(3)步骤③的目的是除去Fe和Cr,温度不能太高的原因是___________。若在![]() 时,调pH=4除去铁,此时溶液中
时,调pH=4除去铁,此时溶液中![]() ______________。
______________。
(4)粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度镍,下列叙述正确的是_ ___(已知:氧化性Fe2+<Ni2+<Cu2+)
A.粗镍作阳极,纯镍作阴极
B.阳极发生还原反应,其电极反应式:![]()
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.电解后,溶液中存在的金属阳离子只有Cu2+和![]()
E.电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目: 来源: 题型:
【题目】香料G的一种合成工艺如图所示。
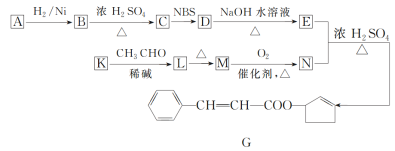
已知:ⅰ.A的分子式为C5H8O,其核磁共振氢谱显示有两组峰,其峰面积之比为1∶1;ⅱ.CH3CH2CH=CH2![]() CH3CHBrCH=CH2;
CH3CHBrCH=CH2;
CH3CHO+ CH3CHO![]()
![]() ;
;
![]()
![]() CH3CH=CHCHO+H2O。请回答下列问题:
CH3CH=CHCHO+H2O。请回答下列问题:
(1)G中含氧官能团的名称为_______,B生成C的反应类型为_______。
(2)A的结构简式为______。
(3)写出D→E的化学方程式:__________。
(4)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_________。
(5)F是比M多一个碳原子的同系物,满足下列条件的F的同分异构体有_____种(不考虑立体异构),其中核磁共振氢谱显示5组峰的结构简式为_____。
①能发生银镜反应②能与溴的四氯化碳溶液发生加成反应③苯环上有2个取代基
(6)以2丙醇和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)____。请用以下方式表示: 
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
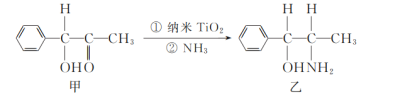
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
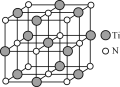
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在化工生产、污水处理中广泛涉及硫单质及其化合物。
Ⅰ.煤制得的化工原料中含有羰基硫(O===C===S),该物质可转化为H2S,主要反应如下:①水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1,②氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1。
(1)请计算CO(g)和H2O(g)生成H2(g)和CO2(g)的反应热ΔH=______。
(2)在定温定容的密闭容器中进行反应①,下列事实说明反应①达到平衡状态的是_____(填字母)。
A.容器的压强不再改变
B.混合气体的密度不再改变
C.化学平衡常数不再改变
D.生成1 mol H—O键,同时生成1 mol H—S键
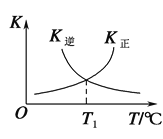
(3)反应②的正、逆反应的平衡常数(K)与温度(T)的关系如图所示。在T1 ℃时,向容积为5 L的密闭容器中加入2 mol COS(g)和1 mol H2(g),充分反应,COS的平衡转化率为______。
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:2H2S(g) ![]() 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如图所示。
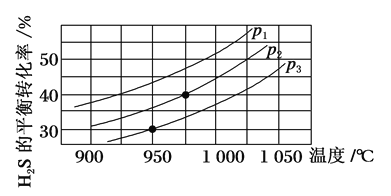
(4)图中压强p1、p2、p3由大到小的顺序是______。
(5)在950 ℃,压强为p3时,反应经30 min达到平衡,则平均反应速率v(H2)=_______。
(6)在p2=6 MPa,温度为975 ℃时,请计算该反应的平衡常数Kc为_____(保留2位有效数字)。对于气相反应,用某组分(B)的平衡分压(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),pB=p总×B的物质的量分数,则此条件下该反应的平衡常数Kp=___MPa。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了检验淀粉水解的产物,设计如下实验方案:
![]()
请回答下列问题:
(1)试剂1为20%的H2SO4溶液,其作用是_________;
(2)试剂2为_________NaOH溶液,其作用是_________,使检验水解产物的实验得以顺利进行;发生反应的离子方程式为:_________;
(3)反应①的化学方程式为_________;
(4)为检验淀粉液是否已完全水解,取少量水解液于试管中,加入碘水,则证明淀粉未完全水解的现象是_________;
(5)如果实验过程中没有加入试剂2而直接加入试剂3,能否实现实验目的_________(填”能”或”否”)否,若不能,其原因是_________硫酸能溶解Cu(OH)2而使实验失败,最简单的改正措施是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com