
科目: 来源: 题型:
【题目】根据下列实验操作和现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 溶液红色褪去 |
|
B | 分别向盛有 | a中溶液变蓝,b中产生黄色沉淀 |
|
C | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热 | 未见有银镜产生 | 淀粉没有水解 |
D | 向无水乙醇中加入浓硫酸,加热,产生的气体通入酸性 | 溶液紫色褪去 | 气体中含有乙烯 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含V2O3、CuO、MnO、SiO2、Al2O3、有机物
含V2O3、CuO、MnO、SiO2、Al2O3、有机物![]() 为原料制备V2O5的一种流程如图:
为原料制备V2O5的一种流程如图:
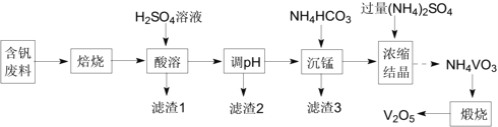
已知:25℃时,难溶电解质的溶度积常数如表所示:
难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
Ksp | 2.2×10-20 | 4×10-14 | 1.9×10-33 |
(1)“焙烧”的目的是__;
(2)“滤渣1”的用途为__![]() 写出2种即可
写出2种即可![]() ;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__
;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全
溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为__;
(4)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为__;
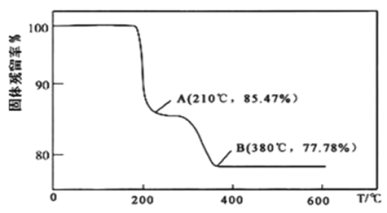
(5)在煅烧NH4VO3生成的V2O5过程中,固体残留率(![]() ×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。
×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。![]() 填写分子式
填写分子式![]()
(6)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入足量稀硫酸使其完全反应,生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol·L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+黄色![]() 被还原为VO2+蓝色
被还原为VO2+蓝色![]() ,该反应的离子方程式为__;该产品的纯度为__。
,该反应的离子方程式为__;该产品的纯度为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在卤代烃RCH2CH2X中化学键如图:

则对该卤代烃的下列说法中正确的是 ( )
A.不能发生水解反应和消去反应
B.能发生水解反应,条件是强碱的醇溶液且加热,被破坏的键是①和④
C.能发生消去反应,条件是强碱的水溶液且加热,被破坏的键是①和②
D.发生水解反应时,被破坏的键是①;发生消去反应时,被破坏的键是①和③
查看答案和解析>>
科目: 来源: 题型:
【题目】有![]() 、CH3CH2OH、CH3CH2Br、NH4Cl四种无色液体,只有一种试剂就能把它们鉴别开,这种试剂是( )
、CH3CH2OH、CH3CH2Br、NH4Cl四种无色液体,只有一种试剂就能把它们鉴别开,这种试剂是( )
A.溴水B.NaOH溶液C.Na2SO4溶液D.KMnO4溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】下列混合物中可用分液漏斗分离,且有机物应从分液漏斗上口倒出的是 ( )
A.![]() 、Br2
、Br2
B.CH3Cl、H2O
C.CCl4、CHCl3
D.CH2Br—CH2Br、NaBr(H2O)
查看答案和解析>>
科目: 来源: 题型:
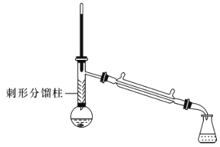
【题目】有“退热冰”之称的乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,纯乙酰苯胺是一种白色有光泽片状结晶,不仅本身是重要的药物,而且是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。实验室用苯胺与乙酸合成乙酰苯胺的反应和实验装置如图(夹持及加热装置略):
![]() +CH3COOH
+CH3COOH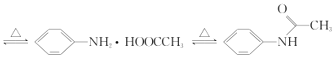 +H2O
+H2O
注:①苯胺与乙酸的反应速率较慢,且反应是可逆的。
②苯胺易氧化,加入少量锌粉,防止苯胺在反应过程中氧化。
③刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
可能用到的有关性质如下:(密度单位为g/cm3)
名称 | 相对分子质量 | 性状 | 密度/gcm3 | 熔点/℃ | 沸点/ | 溶解度 | |
g/100g水 | g/100g乙醇 | ||||||
苯胺 | 93.12 | 棕黄色油状液体 | 1.02 | -6.3 | 184 | 微溶 | ∞ |
冰醋酸 | 60.052 | 无色透明液体 | 1.05 | 16.6 | 117.9 | ∞ | ∞ |
乙酰苯胺 | 135.16 | 无色片状晶体 | 1.21 | 155~156 | 280~290 | 温度高,溶解度大 | 较水中大 |
合成步骤:
在50mL圆底烧瓶中加入10mL新蒸馏过的苯胺和15mL冰乙酸(过量)及少许锌粉(约0.1g)。用刺形分馏柱组装好分馏装置,小火加热10min后再升高加热温度,使蒸气温度在一定范围内浮动1小时。在搅拌下趁热快速将反应物以细流倒入100mL冷水中冷却。待乙酰苯胺晶体完全析出时,用布氏漏斗抽气过滤,洗涤,以除去残留酸液,抽干,即得粗乙酰苯胺。
分离提纯:
将粗乙酰苯胺溶于300mL热水中,加热至沸腾。放置数分钟后,加入约0.5g粉未状活性炭,用玻璃棒搅拌并煮沸10min,然后进行热过滤,结晶,抽滤,晾干,称量并计算产率。
(1)由于冰醋酸具有强烈刺激性,实验中要在__内取用,加入过量冰醋酸的目的是__。
(2)反应开始时要小火加热10min是为了__。
(3)实验中使用刺形分馏柱能较好地提高乙酰苯胺产率,试从化学平衡的角度分析其原因:__。
(4)反应中加热方式可采用__(填“水浴”“油浴”或"直接加热”),蒸气温度的最佳范围是__(填字母代号)。
a.100~105℃ b.117.9~184℃ c.280~290℃
(5)判断反应基本完全的现象是__,洗涤乙酰苯胺粗品最合适的试剂是__(填字母代号)。
a.用少量热水洗 b.用少量冷水洗
c.先用冷水洗,再用热水洗 d.用酒精洗
(6)分离提纯乙酰苯胺时,在加入活性炭脱色前需放置数分钟,使热溶液稍冷却,其目的是__,若加入过多的活性炭,使乙酰苯胺的产率__(填“偏大”“偏小”或“无影响”)。
(7)该实验最终得到纯品7.36g,则乙酰苯胺的产率是__%(结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种药物中间体(G)的一种合成路线如图:

已知:
请回答下列问题:
(1)R的名称是__;R中官能团名称是__。
(2)M→N的反应类型是__。P的结构简式为__。
(3)H分子式是__。
(4)写出Q→H的化学方程式:__。
(5)T是一种与R具有相同官能团的芳香化合物(且组成元素种类相同),T的相对分子质量比R多14。T有__种结构。其中,在核磁共振氢谱上有5组峰且峰的面积比为1:1:2:2:2的结构简式可能有__。
(6)以1,5-戊二醇(![]() )和硝基苯为原料(其他无机试剂自选)合成
)和硝基苯为原料(其他无机试剂自选)合成![]() ,设计合成路线:__。
,设计合成路线:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】1999年4月,比利时查出污染鸡的根源是生产鸡饲料的油脂被二恶英所污染,二恶英是两大芳香族化合物的总称。其中四氯代二苯并二恶英毒性最大,其结构简式为:
下列有关该化合物的说法中正确的是( )

A. 分子式为C12H8O2Cl4
B. 是一种可溶于水的气体
C. 是最危险的致癌物之一
D. 是一种多卤代烃
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年10月9日消息,诺贝尔化学奖颁给约翰●B.古迪纳夫、M●斯坦利●威廷汉和吉野彰,以表彰他们“开发锂离子电池”的贡献。磷酸亚铁锂(化学式:LiFePO4)是锂离子电池电极材料,主要用于动力锂离子电池,作为正极活性物质使用,人们习惯也称其为磷酸铁锂。
(1)基态锂原子核外能量最高的电子电子云轮廓图形状为__;基态磷原子第一电离能比基态硫的__(填“大”或“小”),原因是__。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是__,其中硫、碳的杂化类型分别是__、__。
(3)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为__;亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为__。
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
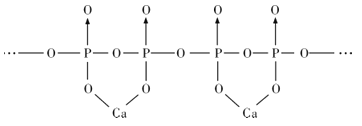
由图推知该多磷酸钙盐的通式为__。
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__,Fe2+与O2-最短核间距为___pm。
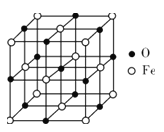
查看答案和解析>>
科目: 来源: 题型:
【题目】利用太阳能、风能、生物质能等可再生能源,转化利用二氧化碳设计出适合高效清洁的合成燃料分子结构,实现CO2+H2O→CxHy的分子转化,生产合成甲烷、醇醚燃料、烷烃柴油、航空燃油等可再生合成燃料。因此二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) △H1=-206.2kJ/mol
CH4(g)+H2O(g) △H1=-206.2kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2
CO2(g)+H2(g) H2
若CO2氧化H2生成0.1molCH4(g)和一定量的H2O(g),整个过程中放出的热量为16.5kJ,则△H2=__。
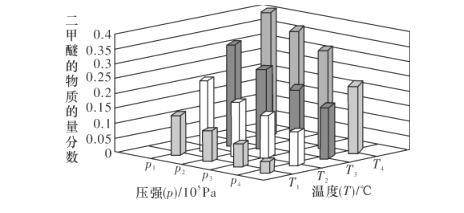
(2)合成二甲醚的总反应为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
CH3OCH3(g)+3H2O(g) H=-122.4kJ·mol-1。某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,则p1__(填“>”“<"或“=”,下同)p2。若T3、p3,T4、p4时平衡常数分别为K3、K4则K3__K4,T1、p1时H2的平衡转化率为___。(结果保留三位有效数字)
(3)向2L密闭容器中加入2molCO2和6molH2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①该反应△H__(填“>”“<”或“=”)0。
②下列叙述能说明此反应达到平衡状态的是__(填字母代号)。
a.混合气体的平均相对分子质量保持不变
b.1molCO2生成的同时有3molH-H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)% | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
CH3OH的产 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为__催化效果最佳。
(4)CO2可用于工业制备草酸锌,其原理如图所示(电解液不参加反应),Zn电极是__极。已知在Pb电极区得到ZnC2O4,则Pb电极上的电极反应式为__。
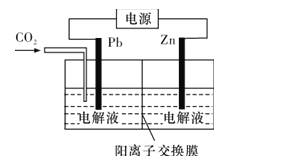
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com