
科目: 来源: 题型:
【题目】科学家们致力于消除氮氧化物对大气的污染。回答下列问题:
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)
2NO2(g) ΔH,该反应共有两步第一步反应为2NO(g)![]() N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
N2O2(g) ΔH1<0;请写出第二步反应的热化学方程式(ΔH2用含ΔH、ΔH1的式子来表示):_______________________________________。
(2)温度为T1时,在两个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
2NO(g)+O2(g),容器I中5min达到平衡。相关数据如表所示:
容器编号 | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
I | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
①容器Ⅱ在反应的起始阶段向_____(“正反应”、“逆反应”、“达平衡”)方向进行。
②达到平衡时,容器I与容器Ⅱ中的总压强之比为___________
a. >1 b. =1 c. <1

(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:υ(NO2)=k1·p2(NO2),υ(N2O4)=k2·P(N2O4),相应的速率与其分压关系如图所示。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间关系是k1=______;在上图标出点中,指出能表示反应达到平衡状态的点是_____,理由是______________。
(4)可用NH3去除 NO,其反应原理4NH3+6NO=5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3时,得到NO脱除率曲线如图所示:
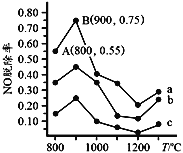
①曲线a中,NO的起始浓度为6×10-4 mg·m-3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为_______mg/(m3·s)。
②曲线b对应NH3与NO的物质的量之比是_____。
(5)还可用间接电解法除NO。其原理如图所示:

①从A口中出来的物质的是__________________。
②写出电解池阴极的电极反应式_______________。
③用离子方程式表示吸收池中除去NO的原理__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年中国科学家成功合成NiO/TiO2电解水催化剂和新型高效的钙钛矿太阳能电池,为解决能源危机保护环境作出了重大贡献。请回答下列问题:
(1)TiO2与焦炭、Cl2在高温下反应的化学方程式为:TiO2+2C+2Cl2 ![]() TiCl4+2CO。
TiCl4+2CO。
①基态钛原子的价电子排布式为_________________。
②该反应中涉及到的非金属元素的电负性大小顺序为_______________________。
(2)已知NiO/TiO2催化化合物甲生成化合物乙的过程如图所示:

化合物甲的沸点小于化合物乙的沸点,主要原因是___________________。在化合物乙中,氧原子的杂化方式是______________。
(3)CH3NH3+、Ti4+、Pb2+、Cl-等离子是组成新型钙钛矿太阳能电池的主要离子。CH3NH3+离子中H—N—H键的键角比NH3分子中H—N—H键的键角 ______ (填“大”或“小”),原因是_____________ 。
(4)Sb(锑)和Ga(镓)的卤化物有很多用途。一定条件下将SbCl3与GaCl3以物质的量之比为l:l反应得到一种固态离子化合物,有人提出了以下两种结构。你认为下列关于结构和说法中合理的是 ____ 。
a. [SbCl2+][GaCl4-] b. [GaCl2+][SbCl4-] c. 没有相关资料,无法判断
(5)金属钛晶胞(如图1所示)中有若干个正四面体空隙,图1中a、b、c、d四个钛原子形成的正四面体其内部空隙中可以填充其他原子。
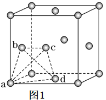
①请回答,金属钛晶胞的结构属于____________。
a. 简单立方 b. 体心立方 c. 面心立方 d. 金刚石型
②若晶胞中所有的正四面体空隙中都填充氢原子,那么形成的氢化钛的化学式为______________。
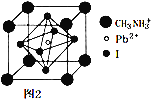
(6)某钙钛矿太阳能电池材料的晶胞如图2所示,其晶胞参数为d pm、密度为ρ g·cm-3。则该晶体的摩尔质量________ g·mol-1。(用含d、ρ等符号的式子表示,用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①③B. ②④
C. ①④D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种烈化物和两种氧化物。某学习小组在实验用C12和NO制备NOCl并测定其纯度,相关实验(装置略去)如下。请回答:
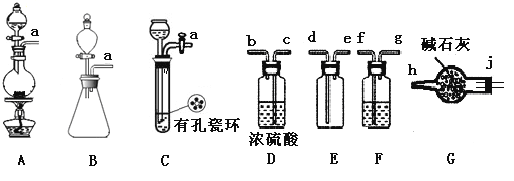
(1)制备Cl2发生装置可______ (填大写字母),反应的离子方程式为_______。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→________(按气流方向,用小写字母表示),若用到F,其盛装药品为_________。
(3)实验室可用下图装置制备亚硝酰氯(NOCl)
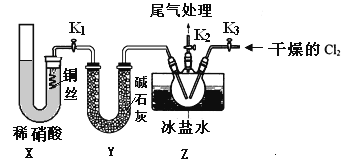
①实验室也可用B装置制备NO,上图X装置的优点为__________(至少写出两点)
②检验装置气密性并装入药品,打开k2,然后再打开____(填“k1”或“k3”),通入一段时间气体,其目的为________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装肖Y,则Z中NOCl可能发生反应的化学方程式为_________
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL.已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,则亚硝酰氯(NOC1)的质量分数为____(用代数式表示,不必化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH=-QkJ·mol-1,在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
甲 | 2 | 1 | 0 | Q1 |
乙 | 1 | 0.5 | 0 | Q2 |
丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成1molSO3固体放热![]() kJ
kJ
B.2Q1<2Q2=Q1<Q
C.Q1=2Q2=2Q3=Q
D.2Q2=2Q3<Q1<Q
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁防腐方法有许多种,如图是其中的一种方法,描述正确的是( )
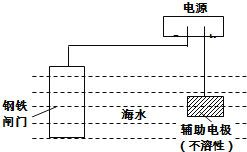
A.如图所示是牺牲阳极的阴极保护法
B.铁闸门作阴极,发生还原反应
C.电子流向:a→铁闸门,辅助电极→b
D.辅助电极上的反应:O2+2H2O+4e=4OH﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛,其实验步骤为:①将三颈烧瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴(Br2),保温反应一段时间,冷却。②将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液,有机相用10%NaHCO3溶液洗涤。③经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。④减压蒸馏有机相,收集相应馏分。(注:MgSO4固体是有机化工生产中常用的一种干燥剂。)
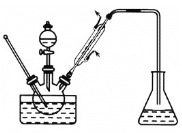
下列说法错误的是
A.步骤①中使用1,2-二氯乙烷的目的是作催化剂,加快反应速率
B.可在该实验装置的冷凝管后加接一支装有无水MgSO4的干燥管,提高实验效果
C.步骤②中有机相用10%NaHCO3溶液洗涤可除去HCl及大部分未反应的Br2
D.步骤④中使用减压蒸馏有机相是因为间溴苯甲醛高温下容易挥发逸出
查看答案和解析>>
科目: 来源: 题型:
【题目】骨胶黏剂是一种极具应用前景的医用高分子材料。某骨胶黏剂的制备原料为聚酯三元醇,其合成原理如下:
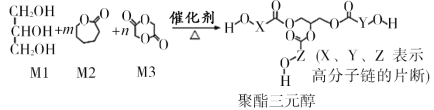
已知:R1COOR2+R318OH![]() R1CO18OR3+R2OH
R1CO18OR3+R2OH
下列说法正确的是
A.单体Ml可用于配制化妆品,且分子中含有3个手性碳原子
B.改变Ml在三种单体中的比例,可调控聚酯三元醇的相对分子质量
C.该合成反应为缩聚反应
D.X、Y、Z中包含的结构片段可能有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,0.1 mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如下图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法错误的是
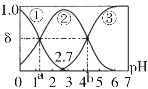
A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.已知pKa=-lgKa,则pKa2 (H2C2O4)=4.17
C.0.1mol/LNaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com