
科目: 来源: 题型:
【题目】(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2_____(填“多”、“少”或“一样多”)。
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(CH3COO-)-c(CH3COOH)=_____mol/L(填准确数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/L Na2A溶液pH=6。
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2_____(填“多”、“少”或“一样多”)。
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A)_____c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A)_____0.2mol/L。
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c(CH3COO-)-c(CH3COOH)=_____mol/L(填准确数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
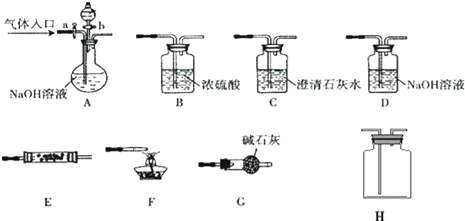
(1)实验前,如何检查A装置的气密:__。
(2)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为__(填代号)。能验证CO氧化产物的现象是__。
(3)若A中气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,H为空瓶,D中改为石蕊试液,按A→G→E→H→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①实验中先用酒精灯加热催化管,再通入混合气体,可观察到H内有红棕色气体出现,D中石蕊试液变红,则E中发生反应的方程式为__。
②若把酒精灯撤去,继续通入气体,催化剂可继续保持红热状态,反应继续进行.能使催化剂继续保持红热的原因是:__。
③某同学在做上述实验时出现了与其他同学不同的现象,他发现催化剂红热现象明显而正常,但石蕊试液不变红.请分析可能的原因:(答1点即可)__。
查看答案和解析>>
科目: 来源: 题型:
【题目】按照要求回答下列问题
(1)硫酸铁溶液显酸性的原因_____(用离子方程式表示).
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显_____性.
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中,c(NH4+)由大到小的顺序_____(填序号).
(4)将化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)B(g)+nC(g),反应到3min时,容器内A的浓度为0.8mol/L,测得这段时间内,平均速率ν(C)=0.6mol/(Lmin),则化学方程式中的n值为_____,ν(B)=_____,此时A的分解率为_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】按照要求回答下列问题
(1)硫酸铁溶液显酸性的原因_____(用离子方程式表示).
(2)物质的量浓度相同的醋酸和氢氧化钠溶液混合溶液中c(CH3COO﹣)=c(Na+),则混合后溶液显_____性.
(3)浓度均为0.1mol/L①氯化铵②醋酸铵③硫酸氢铵④氨水四种溶液中,c(NH4+)由大到小的顺序_____(填序号).
(4)将化合物A的蒸气1mol充入0.5L容器中加热分解:2A(g)B(g)+nC(g),反应到3min时,容器内A的浓度为0.8mol/L,测得这段时间内,平均速率ν(C)=0.6mol/(Lmin),则化学方程式中的n值为_____,ν(B)=_____,此时A的分解率为_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两烧杯中分别盛有100mL 3mol/L的硫酸和NaOH溶液,向两烧杯中各加入等质量的铝粉,反应结束后测得生成的气体体积比为甲︰乙=2︰3,则加入铝粉的质量为
A.5.4gB.7.2gC.8.1gD.10.8g
查看答案和解析>>
科目: 来源: 题型:
【题目】阿魏酸在食品、医药等方面有着广泛用途。一种合成阿魏酸的反应可表示为
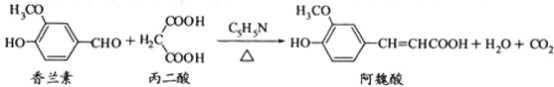
下列说法正确的是
A.可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成
B.香兰素、阿魏酸均可与Na2CO3、NaOH溶液反应
C.通常条件下,香兰素、阿魏酸都能发生取代、加成、消去反应
D.1mol香兰素最多可以与4molH2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质, A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明:NH4NO2不稳定,不考虑),请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知,Ka(HNO2)=4.60×10-4,则0.01molL-1 HNO2和0.01molL-1 A2等体积混合组成溶液中离子浓度由大到小的顺序为_______________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质
的量浓度之比为________。
(5)常温下,0.01molL-1的HCOONa溶液的pH=10,则HCOOH的电离平衡常数Ka=_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
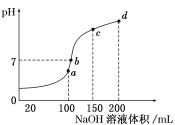
试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com