
科目: 来源: 题型:
【题目】在水的电离平衡中,c(H+)和c(OH)的关系如图所示:
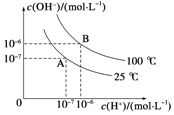
(1)A点水的离子积为1×1014mol2/L2,B点水的离子积为_______.造成水的离子积变化的原因是________。
(2)100℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?为什么?_______ ; ______.
(3)100℃时,若盐酸中c(H+)=5×104mol/L,则由水电离产生的c(H+)是________
查看答案和解析>>
科目: 来源: 题型:
【题目】有机材料PMMA、新型可降解高分子材料PET、常见解热镇痛药Aspirin的合成路线如下:
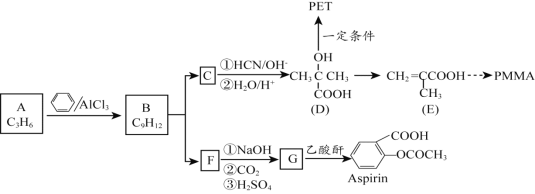
已知:![]()
![]()
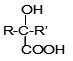
(1)A属于烯烃,其结构简式是_______。
(2)A与苯在AlCl3催化作用下反应生成B的反应类型是_______。
(3)写出B的一溴代物只有2种的芳香烃的名称__________写出生成这两种一溴代物所需要的反应试剂和反应条件____________
(4)B在硫酸催化条件下被氧气氧化可得有机物C与F。
①C由碳、氢、氧三种元素组成, C的结构简式是_________。
②向少量F溶液中滴加几滴FeCl3溶液,溶液呈紫色,且F在其同系物中相对分子质量最小。G物质中含氧官能团名称为_______。
(5)D在一定条件下制取PET的化学方程式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
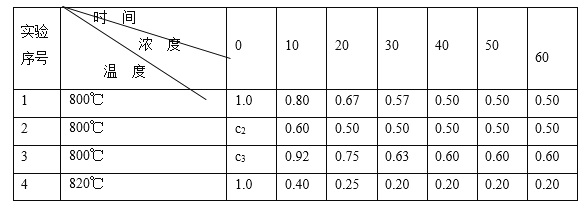
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____反应(选填吸热、放热)。理由是 __________
查看答案和解析>>
科目: 来源: 题型:
【题目】硫的含氧钠盐有许多,现有Na2SO3、Na2S2O3、Na2S2O4(连二亚硫酸钠),其热稳定性比相应的酸强。
已知:2Na2S2O4 =Na2S2O3+Na2SO3+SO2↑
4H++ 2S2O42- = 3SO2↑+ S↓ + 2H2O
完成下列计算:
(1)用Na2S2O3溶液与不同浓度的硫酸反应,可以研究浓度对化学反应速率的影响。现有98%的浓硫酸(密度为1.84g·cm-3)来配制500mL1mol·L(密度为1.06g·cm-3)的稀硫酸,则需要浓硫酸___________mL;加水_______g;
(2)称取部分氧化的亚硫酸钠样品10.16克溶于水,加入稍过量的盐酸酸化了的氯化钡溶液,过滤,洗涤,干燥,所得沉淀质量为2.33克,则该亚硫酸钠中已有_______%(质量分数)的亚硫酸钠被氧化。
(3)现有8.70g的无水Na2S2O4,吸水后得到10.50g Na2S2O4·nH2O,则水合物中n的值是______;
(4)Na2S2O4在500℃时部分分解得产物A,将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况),试确定残留物中钠、硫和氧的原子个数比_______;若取另一份Na2S2O4部分分解得到的产物B,则ag产物B中钠、硫和氧的原子个数比为__________(范围)。
查看答案和解析>>
科目: 来源: 题型:
【题目】光气(COCl2)的分解反应为:COCl2(g)![]() Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):

(1)计算反应在第8min时的平衡常数K=__;
(2)比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)__T(8)(填“<”、“>”或“=”);
(3)若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=__mol·L-1;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小__;
(5)比较反应物COCl2在5~6min和15~16min时平均反应速率的大小:v(5~6)__v(15~16)(填“<”、“>”或“=”),原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】零排放、太阳能、绿色光源等高科技点亮2010上海世博。
(1)世博园区外围设置生态化停车场,有害尾气被纳米光触媒涂料分解为无毒物质,汽车尾气中的下列物质属于由极性键形成的非极性分子的是____。
a.CO b.NO c.NO2 d.CO2
(2)“一轴四馆”中安装了高亮度节能的陶瓷金卤灯,金卤灯中填充物通常包含NA,81Tl、49In、SC,I等元素的单质或化合物.有关说法正确的是_____。
a.第ⅢA元素铊和铟,第一电离能Tl小于In
b.元素Sc位于周期表s区
c.钠的熔点低,是因为金属键较弱
d.I2溶于KI溶液,可产生I3-,由价层互斥理论可推知I3-呈直线形
(3)世博锗广泛采用了冰蓄冷空调.冰蓄冷空调采用液态化合物乙二酵(HOCH2CH2OH)介质,乙二醇沸点高,是由于_____。
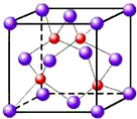
(4)上海城区大规模集中使用“21世纪绿色光源”LED半导体照明,LED晶片采厢砷化镓(GaAs)等材料组成。其中Ga原子在基态时,核外电子排布式为:_____。GaAs的晶胞结构如图,晶胞中含砷原子数为_____。
(5)“东方之冠”(中国馆)表面装有7000多块红色铝板,红色铝板为新型氟碳喷涂型材,一种氟碳涂层聚脂(FEP),它的单体为CF3﹣CF=CF2,该分子中碳原子的杂化方式有:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图所示)

(1)制备实验开始时,先检查装置气密性,接下来的操作依次是______(填序号)
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止.为测定已分离出过量MnO2后的反应残余液中盐酸的浓度,探究小组提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:判定甲方案不可行,理由是______________。
(3)进行乙方案实验: 准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0.1000 mol·L-1NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为_____mol·L-1
b.平行滴定后获得实验结果。
采用此方案还需查阅资料知道的数据是:________。
(4)丙方案的实验发现,剩余固体中含有MnCO3,说明碳酸钙在水中存在______,测定的结果会:______(填“偏大”、“偏小”或“准确”)
(5)进行丁方案实验:装置如图所示(夹持器具已略去)

①使Y形管中的残余清液与锌粒反应的正确操作是将_________转移到_____________中。
②反应完毕,每间隔1分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是______(排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O![]() CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3 [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体,![]() 减小
减小
d.稀释溶液,平衡常数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
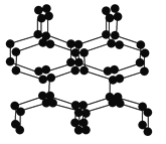
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目: 来源: 题型:
【题目】某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:

完成下列填空
(1)氧原子最外层电子的轨道表示式为__________,该化学用语不能表达出氧原子最外层电子的______(填序号)。
a. 电子层 b. 电子亚层 c. 所有电子云的伸展方向 d.自旋状态
(2)四种元素中有两种元素处于同周期,下列叙述中不能说明这两种元素非金属性递变规律的事实是___________。
a.最高价氧化物对应水化物的酸性 b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价 d.气态氢化物的沸点
(3)由这四种元素中任意3种所形成的常见化合物中属于离子晶体的有_________(填化学式,写出一个即可),该化合物的水溶液显____(填“酸性”、“碱性”或“中性”)。
(4)写出该离子反应的方程式_______________,若将该反应设计成原电池,则N2应该在___________(填“正极”或“负极”)附近逸出。
(5)已知亚硝酸(HNO2)的酸性与醋酸相当,很不稳定,通常在室温下立即分解。则:
①酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I- 被氧化为I2时,产物中含氮的物质为______(填化学式)。
②要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是________(填序号)。
a. 稀硫酸 b. 二氧化碳 c. 二氧化硫 d. 磷酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com