
科目: 来源: 题型:
【题目】无水硫酸铜在加热至650℃时开始分解生成氧化铜和气体.某活动小组通过实验,探究不同温度下气体产物的组成.实验装置如下:
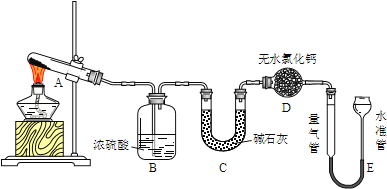
每次实验后均测定B、C质量的改变和E中收集到气体的体积.实验数据如下(E中气体体积已折算至标准状况):
实验组别 | 温度 | 称取CuSO4质量/g | B增重质量/g | C增重质量/g | E中收集到气体/mL |
① | T1 | 0.640 | 0.320 | 0 | 0 |
② | T2 | 0.640 | 0 | 0.256 | V2 |
③ | T3 | 0.640 | 0.160 | Y3 | 22.4 |
④ | T4 | 0.640 | X4 | 0.192 | 33.6 |
(1)实验过程中A中的现象是______.D中无水氯化钙的作用是_______.
(2)在测量E中气体体积时,应注意先_______,然后调节水准管与量气管的液面相平,若水准管内液面高于量气管,测得气体体积______(填“偏大”、“偏小”或“不变”).
(3)实验①中B中吸收的气体是_____.实验②中E中收集到的气体是______.
(4)推测实验②中CuSO4分解反应方程式为:_______.
(5)根据表中数据分析,实验③中理论上C增加的质量Y3=_______g.
(6)结合平衡移动原理,比较T3和T4温度的高低并说明理由________.
查看答案和解析>>
科目: 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+、O2、NO3-等共存物的存在会影响水体修复效果。定义单位时间内ZVI释放电子的物质的量为n1,其中用于有效腐蚀的电子的物质的量为n2。下列说法正确的是
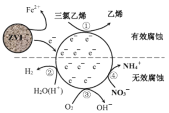
A.反应①在负极发生,②③④均在正极发生
B.单位时间内,三氯乙烯脱去a mol Cl时 n1=amol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.增大单位体积水体中小微粒ZVI的投入量,可使n1、n2均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】水在25℃、100℃两种温度下的电离平衡曲线如下图所示,下列说法正确的是

A.图中四点Kw间的关系是:a=d<c<b
B.从a点到c点,可采用温度不变,在水中加入少量 Na2CO3固体的方法
C.从a点到d点,可采用温度不变,在水中加入少量 NaOH固体的方法
D.若处在b点所在温度,将pH=2的稀H2SO4 (该温度下H2SO4=2H++SO42-)与 pH= 10的NaOH溶液等积混合后,所得溶液呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,具有抗癌的作用.人工合成CPAE的一种路线如下:
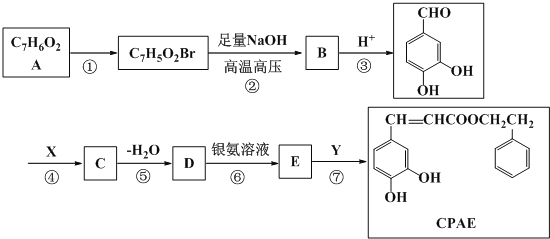
已知:i.A分子中苯环上一溴代物只有2种;
ii.R1﹣CHO+R2﹣CH2﹣CHO→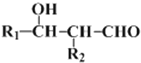
(1)写出反应类型:反应①_______;反应⑤______.
(2)写出结构简式:A______;C_______.
(3)在反应②中,1mol C7H5O2Br最多消耗NaOH____mol.
(4)写出反应方程式:反应⑦________.
(5)写出一种符合下列条件的E的同分异构体__________
i.1mol该物质与1mol Na2CO3反应,生成1mol CO2气体
ii.含有4种化学环境不同的氢原子
(6)写出实验室用Y制备苯乙酮(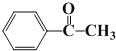 )的合成路线(不超过四步)_____________
)的合成路线(不超过四步)_____________
(合成路线常用的表示方式为:A![]() B…:
B…:![]() 目标产物 )
目标产物 )
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应2Ag+Cl2=2AgCl设计的一种原电池的装置如图。下列说法正确的是
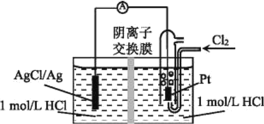
A.负极反应为Cl2+2e-=2Cl-
B.放电时,离子交换膜右侧溶液中有白色沉淀生成
C.理论上,可以用NaCl溶液代替盐酸
D.当电路中有0.01 mole-转移时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目: 来源: 题型:
【题目】氮有多种化合价,能形成多种化合物.工业上用活性炭还原法处理NO,有关反应为:C(s)+2NO(g)N2(g)+CO2(g).向密闭的2L容器中,加入NO和足量的活性炭,恒温条件下反应.
(1)若2min内气体密度增大了1.2g/L,则氮气的平均反应速率为_____mol/(Lmin).
(2)该化学平衡常数表达式K=_____,已知升高温度时,K增大,则正反应为_____(填“吸热”或“放热”)反应.
(3)在温度不变的情况下,要提高NO的平衡转化率,可以采取的措施是_______.
(4)下列各项能判断该反应达到平衡的是______(填序号字母).
a.容器内压强保持不变 b.2v正(NO)=v逆(N2)
c.容器内CO2的体积分数不变 d.混合气体的密度保持不变
(5)已知NaNO2溶液呈碱性,则NaNO2溶液中离子浓度由大到小的顺序是______.
(6)常温下,NaOH溶液和HNO2溶液等体积混合后,所得溶液的pH=7,下列关系正确的是________.
a.c(Na+)>c(NO2﹣) b.c(Na+)=c(NO2﹣)
c.c(Na+)<c(NO2﹣) d.c(Na+)>c(OH﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】NH3可消除NO的污染,反应方程式为:6NO+4NH3→5N2+6H2O.现有NO与NH3的混合物1mol充分反应,若还原产物比氧化产物多1.4g.则下列判断中正确的是( )
A.产生氮气为5.6 L
B.有0.3 mol NO被还原
C.生成氧化产物2.8 g
D.原混合物中NO与NH3的物质的量之比可能为3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO﹣+H2O+SO2→HClO+HSO3﹣
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3﹣+Ca2++2OH﹣→CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH﹣+H++SO42﹣→BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03mol H2S:5OH﹣+3H2S→HS﹣+2S2﹣+5H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温密闭容器中制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)﹣Q,达到平衡后,以下分析正确的是( )
A.加入硫酸镁固体,平衡正向移动
B.达到平衡时,气体的平均分子量保持不变
C.保持体积不变,充入CO,达到平衡的过程中逆反应速率逐渐增大
D.1mol MgSO4和1mol CO反应,达到平衡时吸收热量为Q
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) +yB(g)![]() z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y < zB.平衡向正反应方向移动
C.C的体积分数下降D.B的转化率升高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com