
科目: 来源: 题型:
【题目】室温时几种物质的溶解度见下表。室温下,向500g硝酸钾饱和溶液中投入2g食盐,下列推断正确的是( )
物质 | 溶解度( g/100g水) |
氯化钠 | 36 |
硝酸钾 | 32 |
硝酸钠 | 87 |
氯化钾 | 37 |
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,析出2 g硝酸钾晶体
D.食盐溶解,析出2 g氯化钾晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下:HCO3-+H2O![]() H2CO3+OH- Kh=2.2×10-8
H2CO3+OH- Kh=2.2×10-8
NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
将NH4HCO3溶液和氨水按一定比例混合,可用于浸取矿渣中ZnO。若溶液混合引起的体积变化可忽略。
(1) 0.2 mol·L-1氨水中,c(NH4+)、c(OH-)、c(NH3·H2O)、c(H+)按从大到小的顺序排列为________;常温下,0.2 mol·L-1NH4HCO3溶液 pH________7 (选填“>”、“〈”或“=”)。
(2) 0. 2 mol·L-1 氨水和 0. 2 mol·L-1 NH4HCO3 溶液等体积混合后(NH3 按 NH3·H2O算),c(NH4+)+c(NH3·H2O)=______mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下:
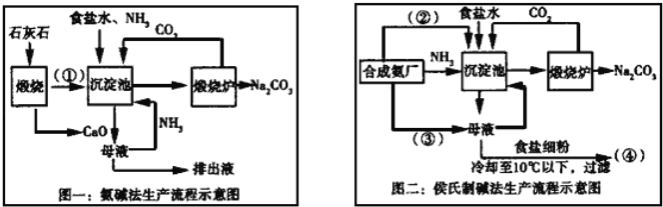
完成下列填空:
(1)写出化学式:②_____、③____
(2)从理论上分析,氨碱法生产过程中_____(选填“需要”、“不需要”)补充氨气,写出该工艺中生成CaCl2的化学方程式________________。
(3)对联碱法中从母液中提取氯化铵晶体的过程进行分析,所得结论合理的是______。
a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气可把碳酸氢钠转化为碳酸钠,防止碳酸氢钠析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
(4)取“侯氏制碱法”生产的纯碱样品5.500g,配成500mL溶液,取25mL溶液用0.1000mol/L的标准盐酸滴定(设其中的杂质不与盐酸反应),用酚酞作指示剂,三次滴定消耗盐酸的平均量为25.00mL.计算样品中纯碱的质量分数______。(已知25℃时0.1mol/L的NaHCO3溶液的pH约为8.3)某活动小组根据上述制碱原理,用如下所示装置(夹持装置省略)制备碳酸氢钠.
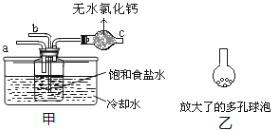
(5)实验时,须先从____管通入_____气体,再从_____管中通入_____气体。
(6)有同学建议在甲装置的b管下端连接乙装置,目的是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I .光气(COCl2)在塑料、制革、制药等工业上有许多用途。制备光气的方法很多, 下列两种方法常用。
(1)方法一:工业上制备光气的原理:CO+Cl2![]() COCl2,其中原料气CO可利用天然气在氧气中不完全燃烧生产,已知:
COCl2,其中原料气CO可利用天然气在氧气中不完全燃烧生产,已知:
CH4(g)+2O2(g) =CO2(g)+2H2O(1) △H = - 890.3 kJ·mol-1
2CO(g)+O2(g)= 2CO2(g) △H =-566 kJ·mol-1
每生产224LCO (标准状况)所放出的热量约为________ kJ。
(2)方法二:实验室可用氯仿(CHCl3)与双氧水反应制备光气,同时还有一种酸性溶液生成。写出实验室制备光气的化学方程式__________。
II.COCl2 的分解反应为:COCl2(g)![]() Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示(第l0min到14 min的COCl2浓度变化曲线未画出):
Cl2(g)+CO(g) △H =+108 kJ·mol-1 ,反应体系达到平衡后,各物质的浓度在不同条件下的变化情况如下图所示(第l0min到14 min的COCl2浓度变化曲线未画出):
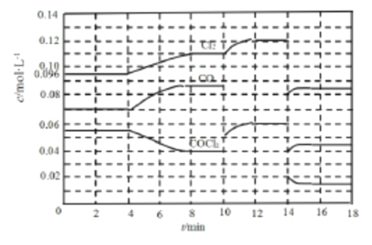
(3)先计算第8 min时CO的浓度,再计算平衡数K=________。
(4)比较第2 min反应温度与第8 min反应温度T8的高低:T2_____T8(选填“ >”、“< ”或“=”)。
(5)若12 min时反应于温度T8下重新达到平衡,则此时c(COCl2)=_____mol·L-1(结果保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应2HI(g)![]() H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
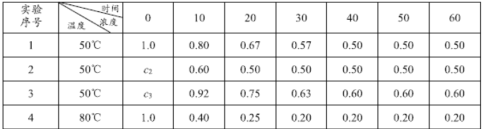
(1)实验1中,反应在010 min内平均速率v(HI)为_______mol·L-1·min-1。仔细分析上表数据可推知Q ______0 (填“>”“<”或“=”)。
(2)实验2中,HI的初始浓度c2 为_____mol·L-1.设平衡前实验1的平均反应速率为v1,平衡前实验3的平均反应速率为v3,则v1 ____v3 (填“>”“<”或“=”),且 c3为________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶性金属氢氧化物在不同pH下的溶解度[S(mol·L-1)]如图所示。
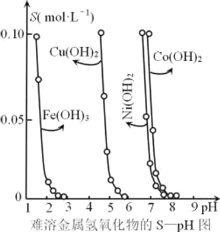
(1)pH=6时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是_____(选填序号)。
A.<2 B. 3.54.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,_______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______.
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为______.
已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的______(选填序号)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目: 来源: 题型:
【题目】烯烃能在臭氧作用下发生键的断裂,形成含氧衍生物:

 +R3COOH
+R3COOH
根据产物的结构可以推测原烯烃的结构.
(1)现有一化学式为C10H18的烃A,经过臭氧作用后可以得到 CH3COOH和B(结构简式如图).

A的结构简式是________________________
(2)A经氢化后得到的烷烃的命名是___________.
(3)烃A的一种同类别同分异构体,经过臭氧作用后,所有产物都不具有酸性.该同分异构体的结构简式是__________.
(4)以B为原料通过三步反应可制得化学式为(C6H10O2)n的聚合物,其路线如下:

写出该聚合物的结构简式:________________.
在进行第二步反应时,易生成一种含八元环的副产物,其结构简式为________.
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸钾与碳酸氢钾都是重要的化学试剂与工业原料,具有广泛的用途.
(1)将碳酸钾、石灰石和二氧化硅进行高温煅烧,可得到组成为K2OCaO6SiO2的钾玻璃,同时排出CO2.若制造5.1kg钾玻璃,排放的CO2在标准状况下的体积是_____L.
(2)已知亚硫酸的酸性强于碳酸.工业上用碳酸钾与碳酸氢钾的混合溶液吸收SO2,充分反应后,所得溶液组成如下表:
物质 | K2CO3 | KHCO3 | K2SO3 |
质量(kg) | 55.2 | 120.0 | 63.2 |
计算原吸收液中碳酸钾与碳酸氢钾的物质的量之比_______________.
(3)根据上表中的数据,计算上表的混合溶液还能吸收SO2的最大质量(不计SO2的溶解)._____________
(4)将热的浓CuSO4溶液与K2CO3溶液混合,析出物中有一种蓝色粒状晶体(不含结晶水),式量为376,其中钾元素的质量分数为0.104.取0.02mol该晶体溶于足量的稀盐酸中,没有气体产生,再加入BaCl2,产生9.32g白色沉淀,通过计算推断晶体的化学式.___
查看答案和解析>>
科目: 来源: 题型:
【题目】I. X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。X可分别与Y、W 形成X2Y、X2Y2、XW等共价化合物;Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
(1)Z2Y2的电子式为________。
(2)写出化合物ZX与稀硫酸反应的离子方程式_______。
(3)常温下,实验测得0.lmol/L的X2Y2的水溶液的pH=5.4,则X2Y2在水中的电离方程式为_______。
II.利用电解饱和ZW溶液及CuCl 溶液合成1, 2—二氯乙烷的实验装置如图所示。

(4)离子交换膜X为_________(选填“阴”或“阳”)离子交换膜;该装置总反应的化学方程式为_______。
(5)要生成1 mol ClCH2CH2Cl,则释放出的H2在标准状况下的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com