
科目: 来源: 题型:
【题目】某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字试验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是( )
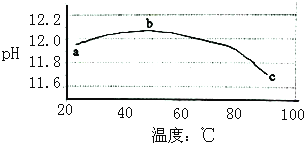
A.碳酸钠水解是吸热反应
B.ab段说明水解平衡向右移动
C.bc段说明水解平衡向左移动
D.水的电离平衡也对pH产生影响
查看答案和解析>>
科目: 来源: 题型:
【题目】以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 的一溴代物和
的一溴代物和 ![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B.CH3CH=CHCH3 分子中的四个碳原子在同一直线上
C.按系统命名法,化合物 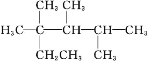 的名称是:2,3,4-三甲基-2-乙基戊烷
的名称是:2,3,4-三甲基-2-乙基戊烷
D.C6H14的同分异构体有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】新型材料B4C可用于制作切削工具和高温热交换器。关于B4C的推断正确的是
A. B4C是一种分子晶体B. B4C是该物质的分子式
C. B4C是一种原子晶体D. B4C的电子式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。___________
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)___________
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况),计算此钢样粉末中铁和碳的物质的量之比。___________
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度___________
(5)若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)___________
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。
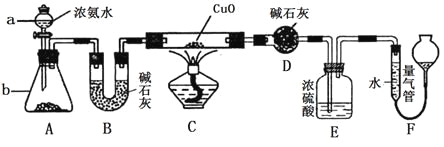
请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:_______________________________。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸是一种重要的化工原料,完成下列填空:
I、工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气。反应为:N2(g)+3H2(g) ![]() 2NH3(g)+Q。
2NH3(g)+Q。
(2)下列措施可以提高H2的转化率的是(填选项序号)_____________。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3 d.升高温度
(3)一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的15/16,则N2的转化率α1=_____;若容器压强恒定,达到平衡状态时,N2的转化率为α2,则α2___α1 (填“>”、“<”或“=”)。
II、以氨气、空气为主要原料制硝酸。
(4)氨气催化氧化的催化剂是___________;氨气也可以在纯氧中燃烧生成无毒、无污染的产物,其燃烧方程式为_____________。
(5)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)![]() 2NO2(g)-Q。该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______。
2NO2(g)-Q。该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______。
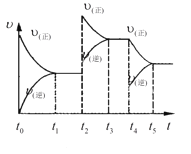
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值
III、硝酸厂常用如下2种方法处理尾气。
(6)催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+ O2(g)→2H2O(g) + 483.6 KJ
N2(g)+ 2O2(g)→2NO2 (g) + 67.7KJ
则H2还原NO2生成水蒸气反应的热化学方程式是_________。
(7)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。若9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则反应的离子方程式是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应 N2(g)+3H2(g)2NH3(g) △H<0,下列研究目的和图示相符的是
A.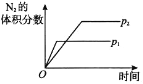 压强对反应的影响(p2>p1)
压强对反应的影响(p2>p1)
B.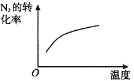 温度对反应的影响
温度对反应的影响
C.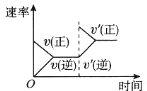 平衡体系增加 N2对反应的影响
平衡体系增加 N2对反应的影响
D.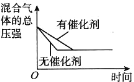 催化剂对反应的影响
催化剂对反应的影响
查看答案和解析>>
科目: 来源: 题型:
【题目】我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S + 2KNO3 + 3C → K2S + 3CO2↑+ N2↑。请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是________;钾元素在周期表中的位置为___________________。
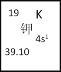
(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其原子核外有_____种不同能级的电子;已知其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是__________________________________。
(3)上述反应生成物中,属于非电解质的是_________________(写结构式);其中熔点最高的物质的电子式是______________。
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_______________,能证明其递变规律的事实是_______________(填字母)。
A、最高价氧化物对应水化物的酸性 B、气态氢化物的沸点
C、单质与氢气反应的难易程度 D、其两两组合形成的化合物中元素的化合价
(5)上述反应中,如1.5mol还原剂________(填“得到”或“失去”)________ mol电子,则生成_________ g还原产物。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的氯气通入60 mL浓度为10.00 mol/L的热的氢氧化钠浓溶液中,溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断不正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-) 可能为7∶3
C.若反应中转移的电子为n mol,则0.3 n 0.5
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com