
科目: 来源: 题型:
【题目】某同学查阅资料得知25℃时部分弱酸的电离常数如下表:
酸 | HCOOH | HClO | H2CO3 | H2C2O4 | H2S |
电离常数(Ka) | 1.8×10-4 | 3×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 | K1=1.3×10-7 K2=7.1×10-15 |
据此回答以下几个问题:
(1)四位同学根据表中数据写出以下几个反应方程式
甲:![]()
乙:![]()
丙:![]()
丁:![]()
上述反应可以成功进行的是______(填同学代号)。
(2)甲同学为证明 HCOOH 为弱酸,采用以下方法一定能证明的是_______(填序号)。
①常温下测得HCOONa溶液的pH大于7
②用HCOOH 溶液做导电实验,灯泡很暗
③HCOOH与Na2S能发生反应产生臭鸡蛋气味的气体
④采用pH计测得常温下 0.1 mol/L HCOOH 溶液的pH=1.37
⑤HCOONa和H3PO4反应,生成 HCOOH
⑥pH=2的HCOOH溶液稀释至100倍后,测得pH约为3.4
(3)乙同学取10.00 mL 0.1 mol/L H2C2O4在室温下用0.1 mol/L NaOH 溶液进行滴定,并使用氢离子浓度监测仪进行实时监控,当电脑显示 pH=7并稳定时停止滴定,此时测得消耗NaOH 溶液体积为V mL。
①该实验可使用________量取10.00 mL 0.1 mol/L H2C2O4(填仪器名称)。
②V____10.00 mL(填“>”“="或“<”)。
③滴定结束后溶液中所含离子浓度由大到小为:_________(书写离子浓度符号并用“>”连接)。
④丙同学与甲同学做同样实验。但他将0.1 mol/L H2C2O4换成0.1 mol/L H2S溶液,丙同学实验结束后溶液c(HS-)___ c(S2-)(填">""<"或“=”)。
(4)已知酸性高锰酸钾可将甲酸氧化成二氧化碳,丁采用 HCOOH 溶液对某KMnO4样品进行纯度测定(杂质不参导反应),取0.200 g KMnO4样品(M=158 g/mol)在锥形瓶中溶解并酸化后,用0.100 mol/L的标准HCOOH溶液进行滴定,滴定至终点时消耗 HCOOH 溶液20.00 mL。
①对 KMnO
②确定达到滴定终点的判断方法是_________。
③该样品中KMnO4的纯度为 _______(用百分数表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】白藜芦醇是肿瘤的化学预防剂,也是对降低血小板聚集,预防和治疗动脉粥样硬化、心脑血管疾病的化学预防剂。花生、葡萄(红葡萄酒)、虎杖、桑椹等植物含有相当多的白蓼芦醇,白藜芦醇是“100种最热门有效抗衰老物质”之一。其结构简式如图,下列有关说法正确的是( )
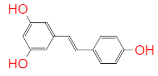
A.白藜芦醇属于酚类物质,是一种天然的抗氧化剂
B.白藜芦醇极易溶于水,遇Fe3+能发生显色反应,还能被高锰酸钾氧化
C.1 mol 白藜芦醇最多能与 NaOH或H2反应的物质的量为3 mol、6 mol
D.白藜芦醇的所有原子一定不在同一平面
查看答案和解析>>
科目: 来源: 题型:
【题目】探究SO2和氯水的漂白性,设计了如下实验,装置如图.完成下列填空:
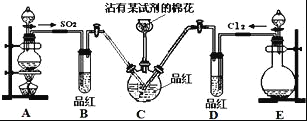
(1)棉花上沾有的试剂是NaOH溶液,作用是______.
(2)①反应开始一段时间后,B、D两个试管中可以观察到的现象分别是:B:_____,D:____.
②停止通气后,分别加热B、D两个试管,可以观察到的现象分别是:B:_____,D:____.
(3)有同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不理想.产生该现象的原因(用化学方程式表示)______.
(4)装置E中用_____(填化学式)和浓盐酸反应制得Cl2,生成2.24L(标准状况)的Cl2,则被氧化的HCl为____mol.
(5)实验结束后,检验蘸有试剂的棉花含有SO42﹣的实验方案是:取棉花中的液体少许,滴加足量的稀HNO3,再加入几滴BaCl2溶液,出现白色沉淀.该方案是否合理____,理由是___.
查看答案和解析>>
科目: 来源: 题型:
【题目】用琥珀酸酐法制备了DEN人工抗原及抗体.如图是1,3﹣丁二烯合成琥珀酸酐的流程:
1,3丁二烯![]() C4H6Br2
C4H6Br2![]() A
A![]() B
B![]() C
C![]()

完成下列填空:
(1)写出反应试剂和反应条件.反应①______;反应②______.
(2)比1,3﹣丁二烯多一个C并且含1个甲基的同系物有______种.
(3)写出A和C的结构简式.A______;C______.
(4)写出B和C反应生成高分子化合物的化学方程式______.
(5)设计一条由1,3﹣丁二烯为原料制备![]() 的合成路线.(无机试剂可以任选)_____
的合成路线.(无机试剂可以任选)_____
(合成路线常用的表示方式为:A![]() B…
B…![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向两支盛有2 mL相同浓度银氨溶液的试管中滴加2滴相同浓度的NaCl和NaI溶液 | 一支产生黄色沉淀,另一只无明显现象 | Ksp(AgI)<Ksp(AgCl) |
B | 向10 mL 0.1 mol/L AgNO3溶液中滴加2滴0.01 mol/L NaBr溶液,再滴加2滴0.01 mol/ LNa2S溶液 | 先产生浅黄色沉淀,然后出现黑色沉淀 | Ksp(AgBr)>Ksp(Ag2S) |
C | 向盛有2 mL 0.1 mol/L MgCl2溶液的试管中先滴加2滴2 mol/L NaOH溶液,再滴加2滴0.01 mol/L CuCl2溶液 | 先产生白色沉淀,然后白色沉淀变蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
D | 将H2S通人浓度均为0.01 mol/L的ZnSO4和CuSO4混合液中 | 先产生黑色的CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.碳酸氢钠的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.向明矾溶液中加Ba(OH)2溶液调节pH=12:Al3++SO42-+4OH-+Ba2+═BaSO4↓ +AlO2-+2H2O
C.将锅炉水垢中的硫酸钙用纯碱溶液处理:CaSO4+CO32―=CaCO3+SO42―,
D.Al(OH)3的酸式电离:Al(OH)3=H++AlO2—+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】浓差电池是电化学电池的一种,主要部分包括正、负两个电极与电解质。一般所说的原电池在电池工作时都有某种化学变化发生,因而被称为化学电池;浓差电池虽然也经历了氧化还原过程,但电池的总反应中并没有反映出这种变化,其净作用仅仅是一种物质从高浓度状态向低浓度状态的转移。如图是利用硫酸铜溶液构成的浓差电池的示意图,下列说法错误的是( )
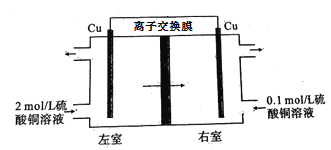
A.电池需采用阳离子交换膜
B.左室发生反应:Cu2++2e—=Cu
C.左室流出硫酸铜溶液物质的量浓度低于2 mol/L
D.工作一段时间后右室电极质量减轻
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定体积容器中发生反应:2CH4(g)+2NH3(g)+3O2(g)=2HCN(g)+6H2O(g),15分钟内测得反应速率用HCN表示为v(HCN)=0.36 mol/(L·min),该段时间内下列表示正确的是( )
A.15分钟内反应消耗氨气5.4 mol
B.该时间内可用水表示反应速率为v(H2O)=1.08 mol/(L·min)
C.各物质的速率关系有:2v(CH4)=2v(NH3)=3v(O2)
D.15分钟内氧气浓度下降8.1 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】稀氨水中存在如下平衡:NH3+H2O ![]() NH3·H2O
NH3·H2O![]() NH4+ + OH-,下列向稀氨水中加入下列物质时的描述错误的是( )
NH4+ + OH-,下列向稀氨水中加入下列物质时的描述错误的是( )
A.加入氯化铵固体,平衡逆向移动,溶液pH降低
B.通入更多氨气,平衡正向移动,溶液碱性增强
C.加入氢氧化钠固体,平衡逆向移动,溶液导电性增强
D.加入适量 NaCl溶液,平衡不移动,溶液pH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 L pH=1的H2SO4溶液中含有0.1 NA个H+
B.各取1 L物质的量浓度均为0.1 mol/L的磷酸钠和磷酸溶液,其中都含有0.1 NA个PO43—
C.室温下,0.01 mol/L CH3COONH4,溶液的pH=7,1 L该溶液中含有NH4+数目有0.01 NA
D.将0.01 mol的AlCl3溶于水并加热形成胶体,所得胶粒数最多为0.01 mol Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com