
【题目】某同学查阅资料得知25℃时部分弱酸的电离常数如下表:
酸 | HCOOH | HClO | H2CO3 | H2C2O4 | H2S |
电离常数(Ka) | 1.8×10-4 | 3×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 | K1=1.3×10-7 K2=7.1×10-15 |
据此回答以下几个问题:
(1)四位同学根据表中数据写出以下几个反应方程式
甲:![]()
乙:![]()
丙:![]()
丁:![]()
上述反应可以成功进行的是______(填同学代号)。
(2)甲同学为证明 HCOOH 为弱酸,采用以下方法一定能证明的是_______(填序号)。
①常温下测得HCOONa溶液的pH大于7
②用HCOOH 溶液做导电实验,灯泡很暗
③HCOOH与Na2S能发生反应产生臭鸡蛋气味的气体
④采用pH计测得常温下 0.1 mol/L HCOOH 溶液的pH=1.37
⑤HCOONa和H3PO4反应,生成 HCOOH
⑥pH=2的HCOOH溶液稀释至100倍后,测得pH约为3.4
(3)乙同学取10.00 mL 0.1 mol/L H2C2O4在室温下用0.1 mol/L NaOH 溶液进行滴定,并使用氢离子浓度监测仪进行实时监控,当电脑显示 pH=7并稳定时停止滴定,此时测得消耗NaOH 溶液体积为V mL。
①该实验可使用________量取10.00 mL 0.1 mol/L H2C2O4(填仪器名称)。
②V____10.00 mL(填“>”“="或“<”)。
③滴定结束后溶液中所含离子浓度由大到小为:_________(书写离子浓度符号并用“>”连接)。
④丙同学与甲同学做同样实验。但他将0.1 mol/L H2C2O4换成0.1 mol/L H2S溶液,丙同学实验结束后溶液c(HS-)___ c(S2-)(填">""<"或“=”)。
(4)已知酸性高锰酸钾可将甲酸氧化成二氧化碳,丁采用 HCOOH 溶液对某KMnO4样品进行纯度测定(杂质不参导反应),取0.200 g KMnO4样品(M=158 g/mol)在锥形瓶中溶解并酸化后,用0.100 mol/L的标准HCOOH溶液进行滴定,滴定至终点时消耗 HCOOH 溶液20.00 mL。
①对 KMnO
②确定达到滴定终点的判断方法是_________。
③该样品中KMnO4的纯度为 _______(用百分数表示)。
【答案】甲、乙、丁 ①④⑤⑥ 酸式滴定管(或移液管) > ![]() > 硫酸 当滴入最后一滴标准液时,溶液由红色变为无色,且半分钟内不变色 63.2%
> 硫酸 当滴入最后一滴标准液时,溶液由红色变为无色,且半分钟内不变色 63.2%
【解析】
由题目所给表格可知,酸性![]() ,得到质子的能力
,得到质子的能力![]() 。
。
(1)根据“强酸制弱酸”原理以及上述分析中酸性和得质子能力的强弱,可判断甲、乙、丁三名同学的方程式能够发生,而丙同学,HClO具有强氧化性,S2-具有还原性,二者会发生氧化还原反应,而不是复分解反应,故答案为甲、乙、丁;
(2)①常温下测得HCOONa溶液的pH大于7,说明HCOONa为强碱弱酸盐,则HCOOH为弱电解质;
② 溶液的导电性与离子浓度成正比,用HCOOH 溶液做导电实验,灯泡很暗,只能说明溶液中离子浓度很小,不能说明HCOOH的电离程度,则不能说明HCOOH为弱电解质;
③ HCOOH与Na2S能发生反应产生臭鸡蛋气味的气体,说明HCOOH的酸性强于H2S,不能说明其为弱电解质;
④采用pH计测得常温下 0.1 mol/L HCOOH 溶液的pH=1.37,说明HCOOH不完全电离,溶液中存在电离平衡,所以能说明其为弱电解质;
⑤强酸可以制取弱酸,HCOONa和H3PO4反应,生成 HCOOH,说明HCOOH的酸性弱于H3PO4,可以说明其为弱电解质;
⑥pH=2的HCOOH溶液稀释至100倍后,测得pH约为3.4,说明HCOOH溶液中存在电离平衡,说明其为弱电解质;
故答案选①④⑤⑥;
(3)①中和滴定实验中,应使用酸式滴定管或移液管量取H2CO4溶液;
②当V=10mL时,溶液中的溶质为NaHC2O4,显酸性,因此当pH=7时,加入NaOH的体积V>10mL;
③ 由题目可知pH=7并稳定时停止滴定,因此滴定结束后溶液中![]() ,根据②可知,该溶液可以看作向NaHC2O4溶液中继续滴加NaOH溶液至中性,因此可得
,根据②可知,该溶液可以看作向NaHC2O4溶液中继续滴加NaOH溶液至中性,因此可得![]() ;
;
④由于HS-离子的水解程度大于电离程度,因此当滴定至pH=7时,溶液中c(HS-)> c(S2-);
(4)①对KMnO4溶液进行酸化时,通常选用的酸是稀硫酸;
②确定达到滴定终点的判断方法是当滴入最后一滴标准液时,溶液由红色变为无色,且半分钟内不变色;
③该滴定发生的反应为![]() ,滴定过程参与反应的草酸的物质的量为0.100 mol/L×20.00 mL=0.002mol,方程式计量关系可知反应的KMnO4物质的量为
,滴定过程参与反应的草酸的物质的量为0.100 mol/L×20.00 mL=0.002mol,方程式计量关系可知反应的KMnO4物质的量为![]() ,其质量为0.0008mol×158g/mol=0.1264g,该样品中KMnO4的纯度为
,其质量为0.0008mol×158g/mol=0.1264g,该样品中KMnO4的纯度为![]() ×100%=63.2%。
×100%=63.2%。


科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)=eC(g)+fD(s) △H。若按反应物的化学计量数比投料,在一定条件下进行反应,该反应达到平衡时C的气体体积分数与温度、压强的关系如图所示。下列叙述正确的是
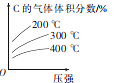
A.该反应的△H >0
B.该化学方程式中m+n>e+f
C.加入催化剂可加快正反应速率,逆反应速率不变
D.往平衡后的恒压容器中再充入一定量C,达到新平衡时,C的浓度与原平衡时的相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
CH3OH(g),下列措施一定使c(CH3OH)/c(CO)增大的是
A. 升高温度
B. 恒温恒容再充入a mol CO和2a mol H2
C. 恒温恒容再充入H2
D. 充入Ar(g)使体系的总压增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E的合成路线如图:

已知:
①
②
完成下列填空:
(1)B中官能团的名称为_____.C2H4生成C2H5Br的反应类型为____.
(2)C的分子式为_____.
(3)检验C2H5Br分子中含有溴原子的实验方案为____.
(4)E的结构简式为![]() ,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
,D在一定条件下转变为E的过程中还会生成另两种具有五元环结构的副产物,写出这两种副产物结构简式_____.
(5)写出一种满足下列条件的有机物的结构简式_____
①分子式只比E少2个氢原子
②与FeCl3发生显色反应
③分子中含有4种不同化学环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式正确的是( )
A.碳酸氢钠的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.向明矾溶液中加Ba(OH)2溶液调节pH=12:Al3++SO42-+4OH-+Ba2+═BaSO4↓ +AlO2-+2H2O
C.将锅炉水垢中的硫酸钙用纯碱溶液处理:CaSO4+CO32―=CaCO3+SO42―,
D.Al(OH)3的酸式电离:Al(OH)3=H++AlO2—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年居里夫妇用α粒子轰击![]() 得到一种自然界不存在的核素
得到一种自然界不存在的核素![]() ,开创了人造核素的先河。其发生的变化如下:
,开创了人造核素的先河。其发生的变化如下:![]() +
+![]() →
→![]() +
+![]() 。下列有关说法错误的是
。下列有关说法错误的是
A.![]() 和
和![]() 两种原子互为同位素
两种原子互为同位素
B.在![]() 中,质子数=中子数=核外电子数
中,质子数=中子数=核外电子数
C.该变化同样遵循质量守恒定律
D.该变化说明原子核在化学反应中也能发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.用原子吸收光谱确定物质中含有哪些金属元素
B.在医疗上硫酸铁可用于生产防治缺铁性贫血的药剂
C.在电流作用下,硫酸钠在水溶液中电离成![]() 和
和![]()
D.加入少量铁粉可防止![]() 溶液变质
溶液变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能是由![]() 、Fe、
、Fe、![]() 、
、![]() 中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,进行如下实验(所加试剂均过量)
中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,进行如下实验(所加试剂均过量)
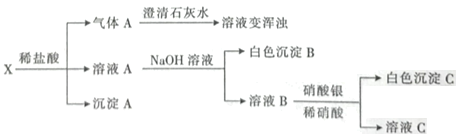
下列说法不正确的是
A.气体A是混合气体
B.沉淀A是![]()
C.白色沉淀B在空气中迅速变为灰绿色,最后变为红褐色
D.该固体混合物一定含有![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
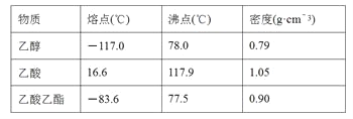
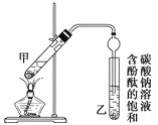
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制2 mL浓硫酸、3 mL乙醇(含18O)和2 mL乙酸的混合溶液。
②按图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热3~5 min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
(1)配制①中混合溶液的方法为____________;反应中浓硫酸的作用是________________;写出制取乙酸乙酯的化学方程式:____________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)_________。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是_______;步骤③所观察到的现象是_________;欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有________;分离时,乙酸乙酯应从仪器________________(填“下口放”或“上口倒”)出。
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如下表:
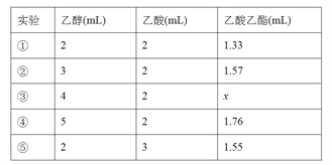
表中数据x的范围是__________________;实验①②⑤探究的是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com