
科目: 来源: 题型:
【题目】锌锰干电池的负极是作为电池壳体的金属锌,正极是被二氧化锰和碳粉包围的石墨电极,电解质是氯化锌和氯化铵的糊状物,该电池放电过程中产生MnOOH。废旧电池中的Zn、Mn元素的回收,对环境保护有重要的意义。
Ⅰ.回收锌元素,制备ZnCl2
步骤一:向除去壳体及石墨电极的黑色糊状物中加水,搅拌,充分溶解,经过滤分离得固体和滤液。
步骤二:处理滤液,得到ZnCl2·xH2O晶体。
步骤三:将SOCl2与ZnCl2·xH2O晶体混合制取无水ZnCl2。
制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)的装置如图:
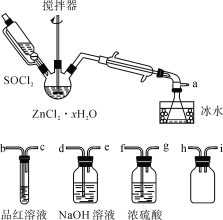
(已知:SOCl2是一种常用的脱水剂,熔点-105℃,沸点79℃,140℃以上时易分解,与水剧烈反应生成两种气体。)
(1)写出SOCl2与水反应的化学方程式:__。
(2)接口的连接顺序为a→__→__→h→i→__→__→__→e。
Ⅱ.回收锰元素,制备MnO2
(3)洗涤步骤一得到的固体,判断固体洗涤干净的方法:__。
(4)洗涤后的固体经初步蒸干后进行灼烧,灼烧的目的:__。
Ⅲ.二氧化锰纯度的测定
称取1.40g灼烧后的产品,加入2.68g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参与反应),充分反应后冷却,将所得溶液转移到100mL容量瓶中用蒸馏水稀释至刻线,从中取出20.00mL,用0.0200mol/L高锰酸钾溶液进行滴定,滴定三次,消耗高锰酸钾溶液体积的平均值为17.30mL。
(5)写出MnO2溶解反应的离子方程式__。
(6)产品的纯度为__。
(7)若灼烧不充分,滴定时消耗高锰酸钾溶液体积__(填“偏大”“偏小”“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】N和S是重要的非金属元素,聚氮化硫(SN)x是重要的超导材料,目前己成为全球材料行业研究的热点。回答下列问题:
(1)下列电子排布图能表示氮原子的最低能量状态的是_____(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.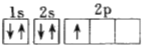
(2)S原子的基态原子核外有____个未成对电子,有__________种不同形状的电子云。
(3) S、N、O三种元素的第一电离能由大到小的顺序为________,列举一种与SCN-互为等电子体的分子为_______。
(4) (CH3)3N中N原子杂化方式为_______;As与N是同主族元素,AsH3的相对分子质量比NH3大,实验测得AsH3沸点比NH3低,其原因是___________。
(5) GaN是一种重要的半导体材料,其晶胞结构和金刚石类似,其晶胞结构如图。
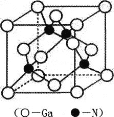
①氮化镓中氮原子与镓原子之间以_______键相结合,与同一个Ga原子相连的N原子构成的空间构型为_______。
②GaN晶体的晶胞边长为a pm,摩尔质量为M g/mol,阿伏加德罗常数的值为NA,则GaN晶体的密度为_______gcm-3 (只要求列算式,不必计算出结果,1pm=l0-12m)。
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
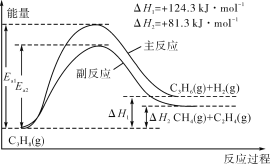
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)__(填“增大”“减小”或“不变”,下同),转化率α(C3H8)__。
②温度升高,副反应更容易发生的主要原因是__。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。

①104Pa时,图中表示丙烯的曲线是__(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=__(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为__。
②298K时,该工艺总反应的热化学方程式为__。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项中所示物质间的转化均能实现的是( )
A.CH3CH2CH2Br![]() CH3CH=CH2
CH3CH=CH2![]() CH3CHBrCH2Br
CH3CHBrCH2Br
B.NaOH(aq)![]() C6H5ONa(aq)
C6H5ONa(aq)![]() NaHCO3(aq)
NaHCO3(aq)
C.NaOH(aq)![]() Cu(OH)2浑浊液
Cu(OH)2浑浊液![]() Cu2O(s)
Cu2O(s)
D.石油![]() CH3CH=CH2
CH3CH=CH2![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】将4molN2O4放入2L恒容密闭容器中发生反应N2O4(g) ![]() 2NO2(g),平衡体系中N2O4的体积分数(Φ)随温度的变化如图所示:
2NO2(g),平衡体系中N2O4的体积分数(Φ)随温度的变化如图所示:

(1)D点v(正)____v(逆)(填“>、<或=”)。
(2)A、B、C三点中平衡常数K的值最大的是____点。T2时N2O4的平衡转化率为____;若平衡时间为5s,则此时间内的N2O4平均反应速率为____。
(3)若其条件不变,在T3原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数____(填“增大、不变或减小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铅(PbCl2)常用于焊接和制备铅黄等染料。利用从废旧铅蓄电池中得到的铅膏获取氯化铅的流程如图,试回答下列问题:

已知:①铅膏主要由PbSO4、PbO、PbO2和Pb等组成。
②流程图中的“1”表示液体,“s”表示固体。
③硫酸铅、氯化铅微溶于水,但氯化铅能溶于NaCl溶液中,主要发生反应:PbCl2+Cl-==[PbCl3]-。
(1)铅蓄电池的正极材料是________________(填化学式),放电时负极的电极反应式为________。
(2)“浸取反应”是在加热条件下,用盐酸和氯化钠溶液浸取铅膏的过程,主要发生反应的方程式有PbP
PbO2+Pb+4HCl==2PbCl2+2H2O PbO+2HCl==PbCl2+H2O,
PbSO4+2NaCl==PbCl2+Na2SO4 PbCl2+Cl-=[PbCl3]-
除此之外,PbO2还能与HCl反应产生一种黄绿色气体,该反应的化学方程式是________________;该浸取过程中Pb与盐酸反应产生的H2可能会与________ (填气体名称,下同)、________等混合发生爆炸。
(3)PbCl2(溶液显酸性)在氯化钠溶液中的溶解度随温度的升高而增大,适当地升高温度有利于提高铅的浸取率,当温度高于70℃时,浸取率提高不明显,可能的原因是________________________________;为了提高浸取率,还可以采取的措施是________________________________________。
(4)在室温下静置冷却3h后,过滤得到的氯化铅的回收率可达到85%,过滤后得到的滤液进行循环使用可提高铅的利用率。在循环使用之前需加入氯化钙将SO42-进行沉淀转化,若无此步骤,直接循环使用,溶液中SO42-浓度过大,则会导致的结果是________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀的溶解平衡等,它们都可看作化学平衡。请根据所学的知识回答:
(1)0.1 mol·L-1的NaHSO3溶液的pH约为4.0,请分析NaHSO3溶液显酸性的原因____。
(2)实验室配制FeCl3溶液时,需将FeCl3溶解在较浓盐酸中,然后加水稀释,这样操作的目的是____。
(3)KCN溶液中存在CN—+H2O![]() HCN+OH—,该反应在 25℃时的平衡常数K=____。(已知:25℃时,Ka(HCN)=6.25×10—10)
HCN+OH—,该反应在 25℃时的平衡常数K=____。(已知:25℃时,Ka(HCN)=6.25×10—10)
(4)已知25℃,Kb(NH3·H2O)=1.8×10-5,H2CO3的Ka1=4.2×10-7、Ka2=4.7×10-11。则NH4HCO3溶液的pH____(填“>、<或=”)7。
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表所示(H+和OH—未列出)
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl— |
浓度/mol·L-1 | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a____0.16(填“>、<或=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如黄血盐[K4Fe(CN)6]、普鲁士蓝、血红素等
(1)已知:3K4Fe(CN)6]=2KCN + Fe3C + 3C + (CN)2↑ +2N2↑
①(CN)2分子中σ键和π键的数目比为n(σ)﹕n(π)=____。
②(CN)2在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2),乙二胺易溶于水,除因为是极性分子外,还可能的原因是____。
(2)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,写出外界离子基态核外电子排布式____。
(3)血红素(如图)是血红蛋白的合成原料之一,血红色中的N原子的杂化类型为____,请用“→”在图中标出Fe2+的配位键_________。

查看答案和解析>>
科目: 来源: 题型:
【题目】向10mL1mol·L-1的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )
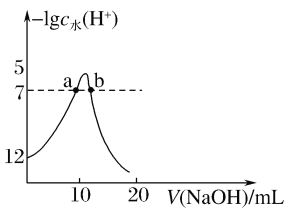
A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
查看答案和解析>>
科目: 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是

A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com