
科目: 来源: 题型:
【题目】如图是元素周期表的一部分:
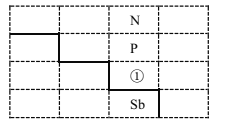
(1)写出元素①的元素符号________,与①同周期的主族元素中,第一电离能比①大的有_______种。
(2)基态锑(Sb)原子的价电子排布式为_______。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+离子的空间构型为______,写出一种与[H2F]+互为等电子体的分子 ____ 。
(3)下列说法正确的是________
a.N2H4分子中含5个σ键和1个π键
b.基态P原子中,电子占据的最高能级符号为M
c.Sb 位于p区
d.升温实现―液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性 共价键。
(4)GaN、GaP都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,解释GaN、GaP熔点变化原因________。

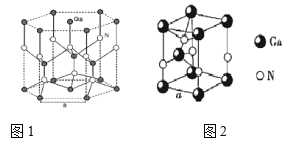
(5)GaN晶胞结构如图1所示,已知六棱柱底边边长为a cm。
①晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为________;
②从GaN 晶体中分割出的平行六面体如图 。若该平行六面体的体积为![]() a3cm3,GaN 晶体的密度为______g/cm3 (用a、NA 表示)。
a3cm3,GaN 晶体的密度为______g/cm3 (用a、NA 表示)。
查看答案和解析>>
科目: 来源: 题型:
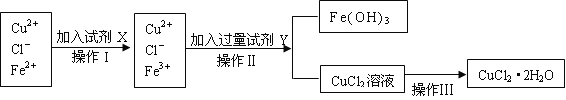
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用使锂的需求量大增,自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。
(1)i.为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈_______,可以认为存在锂元素。
A.紫红色 B.绿色 C.黄色 D. 紫色(需透过蓝色钴玻璃)
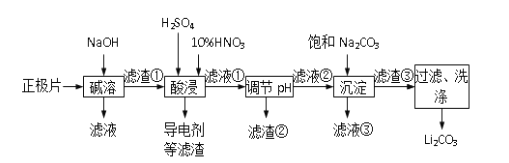
ii锂离子电池的广泛应用同样也要求处理电池废料以节约资源、保护环境。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(由Al箔、LiFePO4活性材料、少量不溶于酸碱的导电剂组成)中的资源,部分流程如图:
查阅资料,部分物质的溶解度(s),单位g,如下表所示:
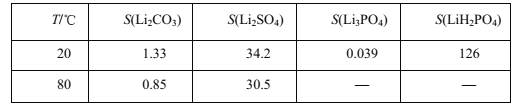
(2)将回收的废旧锂离子电池进行预放电、拆分破碎、热处理等预处理,筛分后获得正极片。下列分析你认为合理的是___ 。
A.废旧锂离子电池在处理之前需要进行彻底放电,否则在后续处理中,残余的能量会集中释放,可能会造成安全隐患。
B.预放电时电池中的锂离子移向负极,不利于提高正极片中锂元素的回收率。
C.热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等。
(3)工业上为了最终获得一种常用金属,向碱溶一步所得滤液中加入一定量硫酸,请写出此时硫酸 参与反应的所有离子方程式 ____________
(4)有人提出在―酸浸时,用H2O2代替HNO3效果会更好。请写出用双氧水代替硝酸时主要反应的化学方程式__________________
(5)若滤液②中c(Li+)=4mol/L加入等体积的Na2CO3后,沉淀中的Li元素占原Li元素总量的95.5%, 计算滤液③中c(CO32-)___________。(Ksp(LiCO)=1.62×10-3)
(6)综合考虑,最后流程中对―滤渣③‖洗涤时,常选用下列________(填字母)洗涤。
A.热水 B.冷水 C.酒精
原因是_______________________
(7)工业上将回收的Li2CO3和滤渣②中FePO4粉碎与足量炭黑混合高温灼烧再生制备 LiFePO4,实现了物质的循环利用,更好的节省了资源,保护了环境。请写出反应的化学方程式:___________________________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1 HCN溶液中滴加0.1 mol·L-1NaOH的溶液,由水电离的氢氧根离子浓度随加入NaOH体积的变化如图所示,则下列说法正确的是 ( )
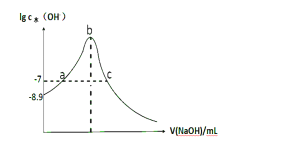
A.常温下,0.1 mol·L-1HCN的电离常数 K a数量级为10-8
B.a、c两点溶液均为中性
C.当 V(NaOH)=10mL时:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D.当V(NaOH)=30mL时:2c(OH-)-2c(H+)=c(CN-)+3c(HCN)
查看答案和解析>>
科目: 来源: 题型:
【题目】某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是__;
(2)已知:
ⅰ.![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.![]()
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去.

请回答:
①步骤Ⅰ的目的是__;
②若G为气体,且相对分子质量是44,则E的结构简式是__;E的核磁共振氢谱中有__个吸收峰(填数字);
③F→H的反应类型是__;
④F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式__;
⑤A的结构简式是__;
上述转化中B→D的化学方程式是__;
(3)已知A的某种同分异构体K具有如下性质:
①K与FeCl3反应,溶液呈紫色
②K在一定条件下可发生银镜反应
③K分子中苯环上的取代基上无甲基
请写出K所有可能的结构简式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是
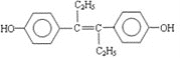
A.M属于芳香族化合物
B.M可与NaOH溶液或NaHCO3溶液发生反应
C.1molM最多能与7molH2发生加成反应
D.1molM与饱和溴水混合,最多消耗5molBr2
查看答案和解析>>
科目: 来源: 题型:
【题目】烷烃是由碳元素和氢元素组成的一类有机物,通常把烷烃泛称“某烷”,“某”是指烷烃中碳原子的数目.碳原子数在十以内的烷烃,依次用“天干”(甲乙丙丁戊己庚辛壬癸)来代表其碳原子数.部分有机物分子组成和结构的表示方法如下:
名称 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
化学式 | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
结构式 |
|
|
|
|
|
据此推测己烷的化学式为( )
A.C6H12B.C6H24C.C6H18D.C6H14
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③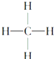 ④
④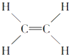 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的是⑤⑦⑧⑨
C. 属于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
查看答案和解析>>
科目: 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀―现象产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )
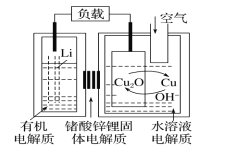
A.放电时,Li+透过固体电解质向右移动
B.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,氧化剂为O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com