
科目: 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是第二周期部分元素基态原子的电子排布图,据此下列说法一定错误的是( )
B C
C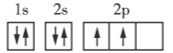
N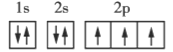 O
O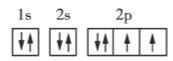
A.每个原子轨道里最多只能容纳2个电子
B.电子排在同一能级的不同轨道上时,总是优先单独占据一个轨道
C.每个能层所具有的能级数等于能层序数
D.若一个原子轨道里有2个电子,则其自旋状态相同
查看答案和解析>>
科目: 来源: 题型:
【题目】图①和图②分别是1s电子的概率密度分布图和电子云轮廓图。下列认识正确的是( )

A.图①中的每个小黑点表示1个电子
B.图②表明1s电子云呈球形,有无数条对称轴
C.图②表示1s电子只能在球体内出现
D.不同能层的s电子云的半径相等
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.原子核外电子排布式为![]() 的原子与原子核外电子排布式为
的原子与原子核外电子排布式为![]() 的原子对应元素的化学性质相似
的原子对应元素的化学性质相似
B.![]() 的最外层电子排布式为
的最外层电子排布式为![]()
C.基态铜原子外围电子排布图为![]()
D.基态碳原子最外层电子排布图为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸银是一种无色晶体,易溶于水。用于照相乳剂、镀银、制镜、印刷、医药、染毛发等,也用于电子工业。硝酸银不稳定,易发生如下反应:
①2AgNO3(s)=2Ag(s)+ 2NO2(g)+O2(g) △H1>0
②2NO2(g) ![]() N2O4(g) △H2<0
N2O4(g) △H2<0
(1)实验室配制硝酸银溶液的方法是:将一定量硝酸银固体溶于浓硝酸中,加水稀释至指定体积。“硝酸”的作用是___________________。
(2)2AgNO3(s) =2Ag(s)+N2O4(g)+O2(g) △H=______________ (用含△H1、△H2的式子表示)。
(3)温度T1时,在0.5L的恒容密闭容器中投入3.4 g AgNO3(s)并完全分解测得混合气体的总物质的量(n)与时间(t)的关系如图所示。
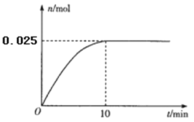
①下列情况能说明体系达到平衡状态的是_________(填字母)
a.固体质量不再改变 b.O2的浓度不再改变
c.NO2的体积分数不再改变 d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强p=0. 3MPa。反应开始到
10min内N2O4的平均反应速率为___________ MPa·min-1。在该温度下2NO2(g)![]() N2O4(g)的平衡常数Kp=___________(MPa)-1(结果保留2位小数)。
N2O4(g)的平衡常数Kp=___________(MPa)-1(结果保留2位小数)。
[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1) =平衡时总压(p)×该组分的体积分数(![]() )]
)]
③实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=2υ(N2O4) 消耗=k逆c(N2O4),k正、k逆为速率常数只受温度影响。则化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1______T2(填“>”、“<”或“=")
(4)NO与O2反应生成NO2的反应历程为:第一步NO+NO![]() N2O2 (快速平衡)
N2O2 (快速平衡)
第二步N2O2+O2=2NO2 (慢反应),下列叙述正确的是___________(填标号)。
A. υ(第一步的正反应) <υ(第二步的反应) B.总反应快慢由第二步决定
C. 第二步的活化能比第一步的高 D.第二步中N2O2与O2的碰撞100%有效
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是(n代表能层序数)( )
A.L电子层不包含d能级
B.s电子绕核旋转,其轨道为一个圆,而p电子是走“∞”形
C.当![]() 时,该能层不一定有四个原子轨道
时,该能层不一定有四个原子轨道
D.当![]() 时,该能层有3s、3p、3d、3f四个原子轨道
时,该能层有3s、3p、3d、3f四个原子轨道
查看答案和解析>>
科目: 来源: 题型:
【题目】现有七种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等 |
B元素原子的核外p电子数比s电子数少1 |
C元素的第一至第四电离能如下: I1=738kJ·mol-1 I2=1451kJ·mol-1 I3=7733kJ·mol-1 I4=10540kJ·mol-1 |
D是前四周期中电负性最小的元素 |
E在周期表的第七列 |
(1)已知BA5为离子化合物,写出其电子式:___。
(2)B元素基态原子中能量最高的电子的电子云在空间有___个伸展方向,原子轨道呈___形。
(3)某同学根据上述信息,推断C基态原子的电子排布图为![]() ,该同学所画的电子排布图违背了___。
,该同学所画的电子排布图违背了___。
(4)E位于第__族、__区,该元素原子的核外电子排布式为___。
(5)检验D元素的方法是___,请用原子结构的知识解释产生此现象的原因:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素A、B、C、D、E、F的原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为1s22s22p6,A原子核外有2个未成对电子,且无空轨道,C单质可与热水反应但很难与冷水反应;E、F原子在基态时填充电子的轨道数为9,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子。
(1)上述六种元素中,第一电离能最大的是__(填元素符号),理由是__。
(2)比较C、D元素的第一电离能:__>__(填元素符号),理由是__。
(3)题述六种元素的电负性由小到大的顺序为__。
(4)C、D、E、F元素形成的最高价氧化物是离子化合物的有__(填化学式,下同),是共价化合物的有__。
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性与非常规超导性之间的联系。回答下列问题:
(1)基态镍原子的电子排布式为[Ar]______________;上述材料中所含元素的基态原子中,未成对电子数最多的是___________(填元素符号)。
(2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)6]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是__________(填元素符号);
(3)K3AsO3可用于碘的微量分析。
①K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为____________。
②AsO33-的立体构型为________,写出一种与其互为等电子体的分子________
(填化学式)。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。
(5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为____。

A.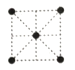 B.
B. C.
C. D.
D.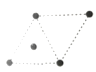
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。
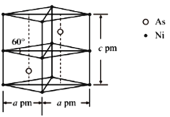
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com