
科目: 来源: 题型:
【题目】高氯酸铵(NH4ClO4)可用作火箭推进剂等。制备NH4ClO4的工艺流程如下:
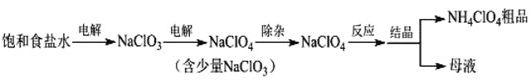
(1)电解NaClO3溶液时,ClO3-在____极发生反应,其电极反应式为____。
(2)“除杂”有两种方案。
①方案1:加入盐酸和H2O2溶液,NaClO3转化为ClO2,化学方程式为______。
方案2:加入氨水和FeCl24H2O,NaClO3转化为Cl-,离子方程式为____,如果FeCl24H2O过量会出现黑色磁性沉淀,该沉淀可能是______。(填化学式)
②比较氧化性:ClO3-_____ClO4-(填“>”或“<”)。
③两种方案相比,方案1的优点是____。(答一条即可)
(3)“反应”时用NaClO4和NH4Cl在90℃制备NH4ClO4。如果用浓盐酸和液氨代替NH4Cl,则无需加热,原因是____。
(4)该流程中可循环利用的物质是_________。(填化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】硼(B)可形成 H3BO3、NaBH4 、NaBO2等化合物,用途广泛。
(1)H3BO3 为一元弱酸,可由硼砂(Na2B4O7﹒10H2O)与盐酸加热反应制得。该反应的化学方程式为____________________。 常温下 0.1 mol·L-1的H3BO3溶液 pH 约为5.0,则H3BO3的电离常数Ka约为____。
(2)在恒容密闭容器中发生储氢反应:BPO4(s)+4Na(s)+ 2H2(g)![]() Na3PO4(s) + NaBH4(s) ΛH<0
Na3PO4(s) + NaBH4(s) ΛH<0
下图为NaBH4产率与反应温度的关系曲线:
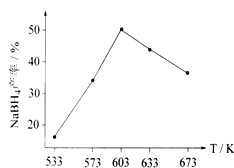
①反应达到平衡时,下列有关叙述正确的是_____。(填标号)
A.生成1mol NaBH4只需1mol BPO4、4mol Na和2 mol H2
B.若向容器内通入少量H2,则v(放氢)< v(吸氢)
C.升高温度,放氢速率加快,重新达到平衡时容器压强增大
D.降低温度,该反应的平衡常数减小
②NaBH4的产率在 603K之前随温度升高而增大的原因是___________________。
(3)NaBH4可水解放出氢气,反应方程式为:NaBH4 + 2H2O=NaBO2 + 4H2↑。
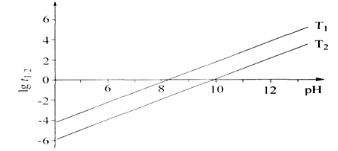
① t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为分钟)。lgt1/2随 pH和温度的变化如图所示。在酸性条件下,NaBH4不能稳定存在,原因是_____(用离子方程式表示);T1__T2。(填“ >” 或“ <”)
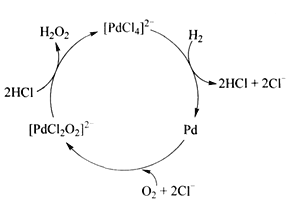
②用H2制备H2O2的一种工艺简单、能耗低的方法, 反应原理如下图所示。总反应的化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
实验装置:(如图所示)
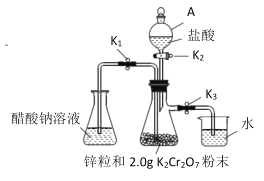
(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)
查看答案和解析>>
科目: 来源: 题型:
【题目】向某密闭容器中充入1mol N2和3molH2,一定条件下发生反应N2(g) + 3H2(g) ![]() 2NH3(g),达到化学平衡时,下列说法正确的是( )
2NH3(g),达到化学平衡时,下列说法正确的是( )
A.反应停止了B.正逆反应速率相等
C.N2的浓度为0D.H2的转化率为100%
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】一种电解法合成氨的装置如图所示,该法采用高质子导电性的 SCY 陶瓷,用吸附在它内外表面上的金属 Pd 多晶薄膜做电极,实现了 570℃、常压下高转化率合成氨。下列叙述正确的是
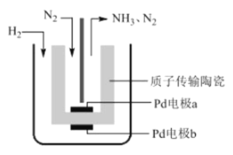
A.阴极的电极反应式为 N2 +8H+ +6e-=2NH4+
B.该装置工作时,H+ 从 a 极区向 b 极区迁移
C.每生成 1mol NH3 ,有 3g H2 被氧化
D.该装置实现了在常温常压下高转化率合成氨
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用下图装置制取无水A1C13(183℃升华,遇潮湿空气即产生大量白雾),下列说法正确的是
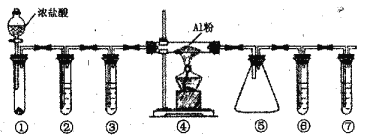
A. ①的试管中盛装二氧化锰,用于常温下制备氯气
B. ②、③、⑥、⑦的试管中依次盛装浓H2SO4、饱和食盐水、浓H2SO4、NaOH溶液
C. 滴加浓盐酸的同时点燃④的酒精灯
D. ⑤用于收集AlCl3,⑥、⑦可以用一个装有碱石灰的干燥管代替
查看答案和解析>>
科目: 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应。
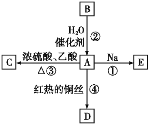
(1)A的官能团名称是_______________________,B的结构简式是________。
(2)反应②的反应类型为______________。
(3)写出反应③的化学方程式:_____________________。
(4)写出反应④的化学方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
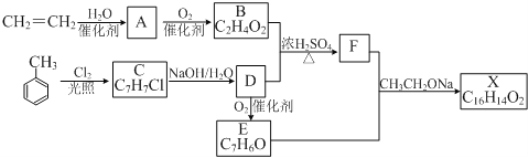
已知:![]() 。请回答:
。请回答:
(1)E中含氧官能团的名称是__________________。
(2)B+D→F的化学方程式____________,除F外图中与该反应类型相同的反应生成了_________(填A—F或X)。
(3)X的结构简式________关于化合物X,下列说法正确的是_______
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.遇溴水会发生取代反应 D.能发生银镜反应
(4)写出一种同时符合下列条件的F的同分异构体,其结构简式为___________
ⅰ. 能发生银镜反应; ⅱ. 能使FeCl3(aq)显色;ⅲ. 有4中不同化学环境的氢原子
(5)乙烯是一种重要的化工原料。若在实验室想通过乙烯制备少量聚氯乙烯,写出可行的合成路线_________(其他无机原料任选)(合成路线的常用表示方法为:![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”是生活中常用的消毒剂,可与硫酸溶液反应制取氯气,反应原理为NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
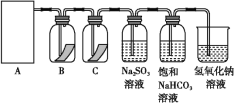
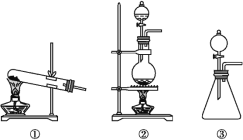
(1)从①、②、③装置中选择合适的制氯气装置(A处)______(填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是________________;说明该装置存在明显的缺陷,请提出合理的改进方法:________________。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,反应的离子方程式为_____,然后检验反应后溶液中是否含有S![]() 。检验S
。检验S![]() 的方法是:取少量反应后的溶液于试管中,先加入足量的________________至无明显现象,然后再加入少量____溶液,有白色沉淀生成,说明含有S
的方法是:取少量反应后的溶液于试管中,先加入足量的________________至无明显现象,然后再加入少量____溶液,有白色沉淀生成,说明含有S![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com