
科目: 来源: 题型:
【题目】元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23、三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3+ Br2+ 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为________,每生成2.24 LO2(标准状况)转移电子数为__________。
24、在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是________________________,相应的离子方程式是_______________________。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)![]() Cl2(aq) ---------------①
Cl2(aq) ---------------①
Cl2(aq)+ H2O![]() HClO + H++Cl------②
HClO + H++Cl------②
HClO![]() H++ ClO----------------③
H++ ClO----------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
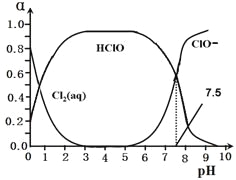
25、写出上述体系中属于电离平衡的平衡常数表达式:Ki =_______,由图可知该常数值为_________。
26、在该体系中c(HClO) + c(ClO-)_______c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
27、用氯处理饮用水时,夏季的杀菌效果比冬季______(填“好”或“差”),请用勒夏特列原理解释________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在含有0.6molCl-、0.8 molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则
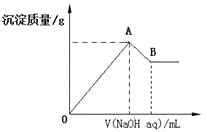
A.x=![]()
B.x的取值范围是0<x<11/32
C.A点横坐标的值随x发生变化
D.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,运用电离理论做出的预测正确的是
A.测定某二元弱酸钠盐溶液的pH,可能小于7
B.稀释0.1mol/LCH3COOH(aq),![]() 可能变大也可能变小
可能变大也可能变小
C.在20.00mL浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00mL
D.pH=8的碱性溶液中一定没有CH3COOH分子
查看答案和解析>>
科目: 来源: 题型:
【题目】化学中常用图像直观地描述化学反应的进程或结果。只改变一个条件,则下列对图像的解读正确的是
①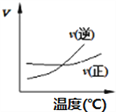 ②
②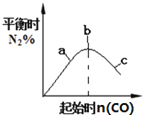 ③
③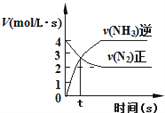 ④
④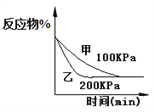
A. A2(g)+3B2(g)![]() 2AB3(g),如图①说明此反应的正反应是吸热反应
2AB3(g),如图①说明此反应的正反应是吸热反应
B. 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
N2(g)+4CO2(g),如图②说明NO2的转化率b>a>c
C. N2(g)+3H2(g)![]() 2NH3(g),如图③说明t秒时合成氨反应达到平衡
2NH3(g),如图③说明t秒时合成氨反应达到平衡
D. 2A(g)+2B(g)![]() 3C(g)+D(?),如图④说明生成物D一定是气体
3C(g)+D(?),如图④说明生成物D一定是气体
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用10 mol/L的浓盐酸配制250mL 1 mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸_________mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______、______等。
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为______g ;设反应后溶液的体积仍为100 mL ,则反应后溶液中H+的物质的量浓度为________。
查看答案和解析>>
科目: 来源: 题型:
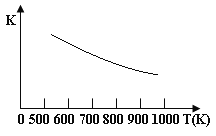
【题目】铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)![]() 3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是
3 FeS(s)+4 H2O(g),其温度与平衡常数的关系如图所示。对此反应原理的理解正确的是
A.H2S是还原剂
B.脱除H2S的反应是放热反应
C.温度越高H2S的脱除率越大
D.压强越小H2S的脱除率越高
查看答案和解析>>
科目: 来源: 题型:
【题目】维生素C的结构简式是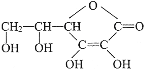 ,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
,它的分子式是______________。由于它能防治坏血病,又称为_______。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有__________性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是___________,说明维生素C具有____________性。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以CaO和HNO3为原料制备Ca(NO3)26H2O晶体。为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为
A.53.8%B.58.3%C.60.3%D.70.0%
查看答案和解析>>
科目: 来源: 题型:
【题目】磷矿石的主要成分是Ca5F(PO4)3,并含有少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4,一种生产流程如下:

已知:Ca5F(PO4)3 + 7H3PO4→5Ca(H2PO4)2 + HF
38、写出有关操作的名称:Ⅰ___________、Ⅲ_________。工艺流程中设计操作Ⅱ与Ⅲ的目的是__________________________________。
39、若在实验室里采用此种方法溶解磷矿石,请写出必须的实验注意事项,并说明理由:_____________。
40、磷矿石也可直接用硫酸溶解,两种工艺相比,该工艺的优点是____________________。
41、测定产品磷酸的浓度可采用滴定法。准确量取10.00 mL磷酸产品(密度为1.526g/cm3)溶于水配成1L溶液;取稀释后的溶液20.00mL,以甲基橙为指示剂,用0.103 mol/L标准NaOH溶液滴定;当观察到溶液恰好变色,且在半分钟内不变色,即为滴定终点(生成NaH2PO4),消耗标准溶液20.16 mL。
该实验过程中需要的定量仪器有______________________________(写名称)。
42、若理论上滴定应耗用标准溶液20.20 mL,则相对误差为______________(按近似计算法则)。该产品中磷酸的质量分数为_____________(保留3位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com