
科目: 来源: 题型:
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成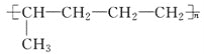 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A. 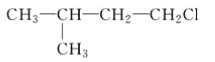 B.
B. 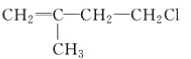 C. CH3CH2CH2ClD.
C. CH3CH2CH2ClD. 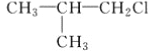
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
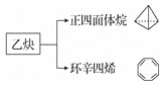
下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是

A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
查看答案和解析>>
科目: 来源: 题型:
【题目】水中的溶解氧(DO)的多少是衡量水体水质的重要指标。某化学小组测定某河流中氧的含量,经查阅有关资料了解到溶解氧测定可用“碘量法”,
Ⅰ.用已准确称量的硫代硫酸钠(Na2S2O3)固体配制一定体积的cmol/L标准溶液;
Ⅱ.用水样瓶取河流中水样v1mL并立即依次序注入1.0mLMnCl2溶液和1.0mL碱性KI溶液,塞紧瓶塞(瓶内不准有气泡),反复震荡后静置约1小时;
Ⅲ.向水样瓶中加入1.0mL硫酸溶液,塞紧瓶塞,振荡水样瓶至沉淀全部溶解,此时溶液变为黄色; Ⅳ.将水样瓶内溶液全量倒入锥形瓶中,用硫代硫酸钠标准溶液滴定;
V.待试液呈淡黄色后,加1mL淀粉溶液,继续滴定到终点并记录消耗的硫代硫酸钠溶液体积为v2。
已知:I2 +2Na2S2O3 =2NaI+Na2S4O6
(1)在滴定环节中使用的仪器有滴定管夹、铁架台、烧杯、锥形瓶和________________________。
(2)在步骤Ⅱ中,水样中出现了MnMnO3沉淀,离子方程式为4Mn2++O2+8OH-![]() 2MnMnO3↓+4H2O。
2MnMnO3↓+4H2O。
(3)步骤Ⅲ中发生反应的离子方程式为 _______________________________________________________________。
(4)滴定时,溶液由__________色到______________色,且半分钟内颜色不再变化即达到滴定终点。
(5)河水中的溶解氧为_____________________________mg/L。
(6)当河水中含有较多NO3-时,测定结果会比实际值________(填偏高、偏低或不变)
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用硫酸铁溶液与铜粉反应,又向反应后溶液中加入KSCN溶液以检验Fe3+是否有剩余,实验记录如下;
实验编号 | 操作 | 现象 |
实验1 |
| i.加入Cu粉后充分振荡,溶液逐渐变蓝; ii.取少量i中清液于试管中,滴加2滴 0.2mol/LKSCN溶液,溶液变为红色,但振荡后红色迅速褪去并有白色沉淀生成。 |
(1)写出实验1中第i步的离子方程式_______________。甲同学猜想第ii步出现的异常现象是由于溶液中的Cu2+干扰了检验Fe3+的现象。查阅相关资料如下
①2Cu2++4SCN- ![]() 2CuSCN↓(白色)+(SCN)2(黄色)
2CuSCN↓(白色)+(SCN)2(黄色)
②硫氰[(SCN)2]:是一种拟卤素,性质与卤素单质相似,其氧化性介于Br2和I2之间。
该同学又通过如下实验验证猜想
实验编号 | 操作 | 现象 |
实验2 |
| 溶液呈绿色,一段时间后后开始出现白色沉淀,上层溶液变为黄色 |
实验3 |
| 无色溶液立即变红,同时生成白色沉淀。 |
(2)经检测,实验2反应后的溶液pH值减小,可能的原因是___________________________________________。
(3)根据实验2、3的实验现象,甲同学推断实验3中溶液变红是由于Fe2+被(SCN)2氧化,写出溶液变红的离子方程式_______________________。继续将实验2中的浊液进一步处理,验证了这一结论的可能性。

补充实验4的目的是排除了溶液存在Cu2+的可能,对应的现象是____________________________________________。
(4)乙同学同时认为,根据氧化还原反应原理,在此条件下,Cu2+也能氧化Fe2+,他的判断依据是_______。
(5)为排除干扰,小组同学重新设计如下装置。
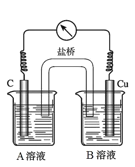
①A溶液为____________________________。
②“电流表指针偏转,说明Cu与Fe3+发生了反应”,你认为这种说法是否合理?__________________(填合理或不合理),原因是__________________________________________。
③验证Fe3+是否参与反应的操作是________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】
铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________.
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有:_____________。
(3)现代工业冶金中,2Au(CN)2-+Zn====2Au+Zn(CN)42-。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如 CH3CH2OH ![]() CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
(5)一种铜镍合金(俗称白铜)的晶胞如图1所示,铜、镍原子个数比为___________。

(6)金晶胞如图2所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(![]() )为___________ (用π含的式子表示),(提示原子空间利用率=
)为___________ (用π含的式子表示),(提示原子空间利用率=![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】氧元素为地壳中含量最高的元素,可形成多种重要的单质和化合物。
(1)氧元素位于元素周期表中_____区;第二周期元素中,第一电离能比氧大的有_____种。
(2)O3可用于消毒。O3的中心原子的杂化形式为_____;其分子的VSEPR模型为_____,与其互为等电子体的离子为_____(写出一种即可)。
(3)含氧有机物中,氧原子的成键方式不同会导致有机物性质不同。解释C2H5OH的沸点高于CH3OCH3的原因为_____。
(4)氧元素可与Fe形成低价态氧化物FeO。FeO立方晶胞结构如图所示,则Fe2+的配位数为_____;与O2-紧邻的所有Fe2+构成的几何构型为_____。
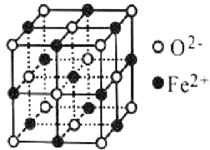
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物是大气主要污染物,主要来自于工业废气及汽车尾气的排放,工业废气中NO是主要成分之一。
(1)乙烯作为还原剂的脱硝(NO),其反应机理示意图如图所示.写出解吸过程的化学方程式____________________。

(2)FeSO4-Na2SO3复合吸收剂吸收烟气中的NO,该方法利用Fe2+易与NO发生络合反应的特性,原理如下NO+FeSO4![]() Fe(NO)SO4
Fe(NO)SO4
①如图是一段时间内不同吸收剂对NO脱除率对比,加入Na2SO3溶液后,吸收效率增强,除了Na2SO3也能吸收部分NO外,还能防氧化从而增大Fe2+的含量,写出此原理的离子方程式_______________________________________。

②模拟实验表明,温度过高或过低都会降低NO的脱除率,其原因是_______________________________________。
(3)采用无隔膜法电解食盐水脱氮可将氮氧化物转化成NO3-,原理如图

①无隔膜条件下电解食盐水后溶液呈弱碱性,原因是____________________________.
②写出NO发生反应的离子方程式____________________________。
③根据下图所示,脱NO过程中控制溶液pH在______________范围内更合理。

查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出COS的电子式__________________,C与O形成共价键时,共用电子对会偏向__________原子,判断依据是___________。
(2)已知COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H1=-34kJ/mol
H2S(g)+CO2(g) △H1=-34kJ/mol
CO(g)+H2O(g)![]() H2(g)+CO2(g) △H2=-41kJ/mol
H2(g)+CO2(g) △H2=-41kJ/mol
写出H2S与CO反应生成COS的热化学方程式__________________________________。
100℃时将CO与H2S按物质的量比为1∶1充入反应器中,达平衡后CO的转化率α=33.3%,此时反应的平衡常数k=________________________。
(3)在充有催化剂的恒压密闭容器中进行反应。设起始充入的n(CO)∶n(H2S)=m,相同时间内测得H2S转化率与m和温度(T)的关系如图所示。
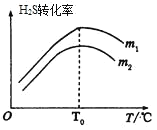
①m1________m2(填>、<或=)
②温度高于T0时,H2S转化率减小的可能原因为_________
a.反应停止了 b.反应的△H变大
c.反应达到平衡 d.催化剂活性降低
查看答案和解析>>
科目: 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示,H+、O2、NO3-等共存物会影响修复效果。下列说法错误的是
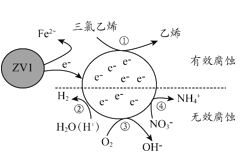
A.反应①②③④均为还原反应
B.1mol三氯乙烯完全脱Cl时,电子转移为3mol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.修复过程中可能产生Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com