
科目: 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是

A.用水湿润的pH试纸测量某溶液的pH
B.用量筒量取20 mL0.5000 mol·L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000 mol· L-1H2SO4溶液
C.实验室用图2所示装置制取少量氨气
D.实验室用图3所示装置除去Cl2中的少量HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】对实验Ⅰ~Ⅳ的实验现象预测正确的是


A.实验Ⅰ:液体分层,下层呈无色
B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C.实验Ⅲ:试管中有红色沉淀生成
D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.含氮化合物在工农业生产中都有重要应用。
(1)氨和肼(N2H4)是两种最常见的氮氢化物。
己知:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g)N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为___________,该反应的化学平衡常数K=__________(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是____________(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆 D.容器中混合气体的平均摩尔质量不变
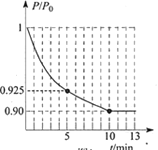
②图为容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)= _____________,平衡时NO的转化率为______________。(已知气体的压强比等于其物质的量之比)
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式________________。
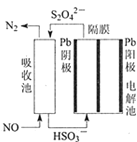
Ⅱ.采用氨水吸收烟气中的 SO2
若氨水与 SO2恰好完全反应生成正盐,则此时溶液呈_________性(填“酸”或“碱”)。 常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10-5molLˉ1;H2SO3 : Ka1=1.3×10-2molLˉ1,Ka2=6.3×10-8molLˉ1
查看答案和解析>>
科目: 来源: 题型:
【题目】在碱的作用下,两分子酯缩合形成β—羰基酯,同时失去一分子醇,该反应称克莱森(R·L·Claisen)酯缩合反应,其反应机理如下:2RCH2COOC2H5![]()
 +C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:
+C2H5OH。利用Claisen反应制备化合物H的一种合成路线如下:

回答下列问题:
(1)A的名称为__________,C的结构简式为__________。
(2)F中含氧官能团的名称是__________;反应Ⅱ的反应类型是__________。
(3)E→F反应的化学方程式为_________________________________。
(4)B的含有苯环的同分异构体有_____________种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、__________。
(5)乙酰乙酸乙酯( ![]() )是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
)是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线(无机试剂任选)。______________
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在。
(1)砷与磷为同一主族元素,砷的原子序数为________________。
(2)根据元素周期律,下列说法正确的是__________________。
a.酸性: H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______。
Ⅱ.(4)A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图:
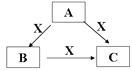
若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为________(写元素名称),它在周期表中的位置为______。
②该金属元素的单质与某氧化物在高温下反应,常用于焊接铁轨及定向爆破,该反应的化学方程式为________。
Ⅲ.铁及其化合物在生活中有广泛应用。
(5)Fe3+基态核外电子排布式为______。
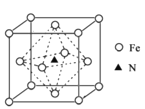
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为______。
(7)某铁的化合物结构简式如图所示:
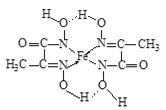
①上述化合物中所含有的非金属元素的电负性由大到小的顺序为______(用元素符号表示)。
②上述化合物中氮原子的杂化方式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
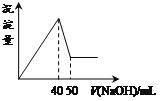
A.1:3B.1:2C.1:1D.2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子反应方程式正确的是( )
A.Fe(OH)3溶于稀 H2SO4 中:H++OH﹣→H2O
B.氨水滴入AlCl3溶液中:Al3++3OH﹣→Al(OH)3↓
C.FeO溶于稀HCl中:O2﹣+2H+→H2O
D.铝溶解在NaOH溶液中:2Al+2OH﹣+2H2O→2AlO2﹣+3H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,电解质溶液的性质与变化是多样的,下列说法正确的是( )
A. pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B. 往稀氨水中加水,![]() 的值变小
的值变小
C. pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+)c=(OH—)+2c(S2—)
D. Ca(ClO)2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )
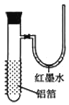
A.实验中发生的反应都是化合反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝
查看答案和解析>>
科目: 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com