
科目: 来源: 题型:
【题目】2019年诺贝尔奖授予了在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、Al等,处理该废料的一种工艺如图所示:

(1)Li的原子结构示意图为_____________,LiCoO2中Co的化合价为_______。
(2)“碱浸”时Al溶解的离子方程式为__________________________________。
(3)“酸溶”时加入H2O2的目的是______________________________________。
(4)“沉钴”的离子方程式为___________________________________________。
(5)配制100 mL 1.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器出玻璃棒、烧杯外,还有_____。
(6)取CoC2O4固体4.41g在空气中加热至300 ℃,得到的钴的氧化物2.41g,则该反应的化学方程式为__________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______%(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______,此时反应中SO2的转化率为_______%(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
第一次 | 1.570 | 0.340 |
第二次 | 3.140 | 0.680 |
第三次 | 4.710 | 0.510 |
第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________。
②试求x的值:________________
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2和CH4催化重整可制备合成气,对减缓燃料危机具有重要意义,其反应历程示意图如图:

下列说法不正确的是( )
A.合成气的主要成分为CO和H2
B.①→②过程可表示为CO2+NiC=2CO+Ni
C.①→②过程吸收能量
D.Ni在该反应中做催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】CoCl2xH2O与Na2CO310H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO310H2O的质量为_______ g(保留2位小数)。
(2)CoCl2xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组用氨碱法制取碳酸钠的原理,在实验室设计下列模拟装置制备NaHCO3(铁架台、C装置水浴中的温度计、酒精灯等略去),然后再制取Na2CO3。提供的试剂有:硫酸、盐酸、石灰石、浓氨水、碳酸氢钾溶液、水、生石灰、食盐等。
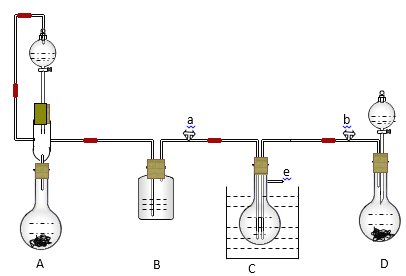
(1)在A中分液漏斗和烧瓶中加入的试剂分别是________、_________;D中分液漏斗和烧瓶中加入的试剂分别为______、________;
(2) B中加入的试剂是______________, 作用是________________________________。
(3)写出C中生成的NaHCO3化学方程式:____________________________________________。
(4)装置A中分液漏斗上方装一导管的主要作用是____________________________________。
(5)实验开始a、b两活塞的正确操作应是(选填序号)_______。
①同时打开a、b两活塞 ②先打开a,后打开b ③先打开b,后打开a
(6)检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是____________________。
(7)由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、_____。
(8)从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源,改进的方法是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。向甲、乙两个体积都为1.0L的恒容密闭容器中均充入2.0molNO2和1.0molO3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表。下列说法不正确的是( )
N2O5(g)+O2(g)。向甲、乙两个体积都为1.0L的恒容密闭容器中均充入2.0molNO2和1.0molO3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表。下列说法不正确的是( )
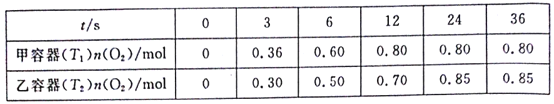
A.T1<T2
B.该反应△H<0
C.甲容器在温度为T1时的平衡常数为20mol·L-1
D.乙容器中,0~3s内的平均反应速率v(NO2)=0.2mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质。
(1)请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式:
________________________________________________________________;
(2)上述所写反应中,硝酸表现出的化学性质是_____,被还原的元素是_______。
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是______(填化学式),若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为____________。
(4)若六种物质组成一个完整的化学反应,且没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
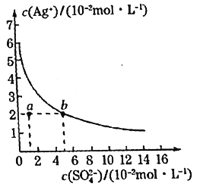
A.含有大量SO42-的溶液中肯定不存在Ag+
B.该温度下,Ag2SO4的溶度积常数(Ksp)的数量级是3
C.可以通过改变温度或加入硫酸银固体使a点移动到b点
D.该温度下,0.02mol·L-1的AgNO3溶液与0.2mol·L-1的Na2SO4溶液等体积混合,不会生成沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加入铝粉能放出氢气的溶液:Na+、Mg2+、Cl-、NO3-;
B.由水电离出的c(OH-)=1.0×10-12mol·L-1的溶液:Fe2+、NH4+、ClO-、SO42-
C.![]() =1.0×10-12的溶液:K+、SO32-、S2-、Cl-
=1.0×10-12的溶液:K+、SO32-、S2-、Cl-
D.c(NH4+)=c(Cl-)的NH4Cl-NH3·H2O混合液:Al3+、Fe3+、SO42-、HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g)![]() CH3OH (g)。
CH3OH (g)。
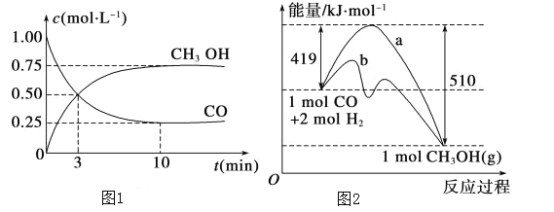
(1)该反应的平衡常数表达式为:K=______________________
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)=____________。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是________(填“吸热”或“放热”)反应,反应的热化学方程式是__________________________________________。
(4)适宜的催化剂能_______(选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有________(选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com