
科目: 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】根据所学化学反应原理,解决以下问题:
(1)请用离子方程式表示泡沫灭火器的工作原理___。
(2)请用离子方程式解释漂白粉和洁厕灵不能混合使用的原因___。
(3)难溶物ZnS可作为沉淀剂除去废水中的Cu2+,写出该过程的离子方程式___。
(4)用CO(g)还原80gFe2O3(s)生成Fe(s)和CO2(g),放热12.4kJ,请写出该反应的热化学方程式___。
(5)已知2CO(g)![]() CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组在实验室从海带中提取碘,设计实验流程如下:
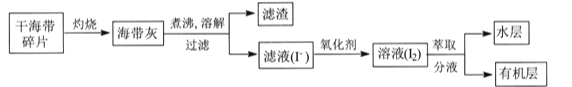
下列说法错误的是
A.过滤操作主要除去海带灰中难溶于水的固体,它们主要是无机物
B.氧化剂参加反应的离子方程式为2I-+H2O2+2H+=I2+2H2O
C.萃取过程所用有机溶剂可以是酒精或四氯化碳
D.因I2易升华,I2的有机溶液难以通过蒸馏法彻底分离
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸、氢硫酸、碳酸在常温下的电离常数如下表:
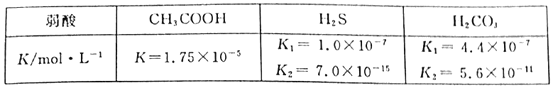
(1)能证明CH3COON是弱酸的事实是___。
A.CH3COOH易挥发
B.常温下,0.1mol·L-1CH3COONa溶液的pH大于7
C.醋酸不易腐蚀衣服
D.pH=3的CH3COOH溶液稀释10倍,溶液pH<4
E.等体积等浓度的CH3COOH溶液和盐酸,分别与足量镁粉反应,产生氢气一样多
F.将一定量的CH3COOH溶液加入Na2CO3溶液中,有气泡产生
(2)煤的气化过程中产生的H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为___。
(3)t℃时,0.0lmol·L-1NaOH溶液的pH=11,则该温度下,水的离子积Kw=___mol2·L-2;该温度下,将pH之和为13的NaOH溶液和CH3COOH溶液等体积混合,所得溶液呈___(填“酸”、“碱”或“中”)性。
(4)在室温下,用蒸馏水稀释0.0lmol·L-1CH3COOH溶液,下列各项呈减小趋势的是___。
A.![]()
B.![]()
C.溶液中c(H+)和c(OH-)的乘积
D.溶液导电性
E.水的电离程度
(5)25℃时,向1m30.1mol·L-1H2S溶液(pH=4)中加入FeSO4·7H2O晶体,当开始生成沉淀时,加入FeSO4·7H2O晶体的质量为___g。
[已知:Ksp(FeS)=6.3×10-18mol-1·L-2,忽略混合过程中的体积变化]
查看答案和解析>>
科目: 来源: 题型:
【题目】一种以肼(N2H4)为燃料的新型环保电池的工作原理如图所示。下列说法正确的是
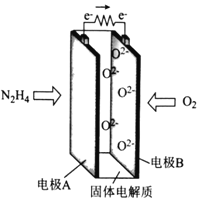
A. 电极A的电势比电极B的低
B. 电极A的电极反应式为N2H4-4e-+4OH-===N2+4H2O
C. 电极B发生氧化反应
D. 每消耗11.2L的O2,转移的电子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】氨是化肥工业和基础有机化工的主要原料。
(1)合成氨反应过程中有关物质的化学键键能数据如下表所示:
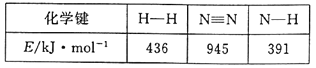
请写出该合成氨反应的热化学方程式___。
(2)一定温度下,合成氨反应在a、b两种条件下分别达到平衡,H2的浓度随时间的变化如图所示。
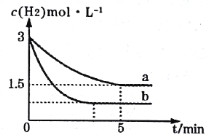
①a条件下,0~5min内的平均反应速率v(N2)=___mol·L-1·min-1。
②相对a而言,b可能改变的条件是___。
(3)某化学兴趣小组向一恒温密闭容器中充入4molN2和12molH2模拟合成氨反应,平衡混合物中氨气的体积分数与总压强(p)的关系如图所示。
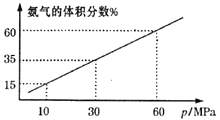
若体系在60MPa下达到平衡。H2的平衡分压为___MPa。(分压=总压×物质的量分数);列式计算此时的平衡常数Kp=___。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(4)下列图示中能表示合成氨反应在恒温、恒容密闭容器中在t1时刻已经达到平衡状态的是___。

查看答案和解析>>
科目: 来源: 题型:
【题目】垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
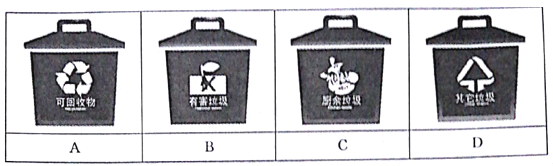
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入___和___垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
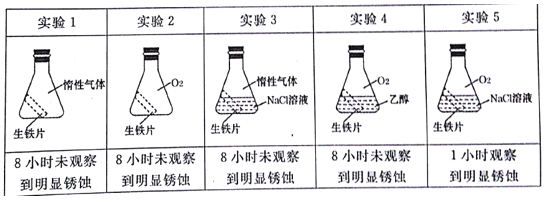
由以上实验可知,金属腐蚀的条件是___。请用电极反应式表示实验5得电子的反应过程___。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。如图装置,可以模拟铁的电化学防护。
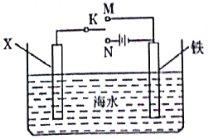
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为___。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图___。

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.密闭容器中2 mol NO与1 mol O2充分反应,产物分子的数目为2NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA
C.标准状况下,22.4 L CCl4含CCl4分子数为NA
D.标准状况下,22.4L N2与CO混合气体的质量为28g
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1的H2B溶液中滴加0.2mol·L-1的NaOH溶液过程中,有关微粒的物质的量变化如图所示,下列说法不正确的是( )

A.I表示H2B,Ⅱ代表HB-、Ⅲ代表B2-
B.当c(Na+)=2c(B2-)+c(HB-)时,溶液呈中性
C.初始时H2B第一级电离的电离度为90%
D.V(NaOH)=20mL时:c(Na+)>c(HB-)>c(B2-)>c(H2B)
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖授予了在锂离子电池发展中做出突出贡献的三位科学家。一种应用于公共交通的高能LiFePO4电池的结构如图所示,电池中间是聚合物的隔膜,工作时只允许Li+通过。该电池工作原理:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。

下列说法不正确的是( )
A.放电时,右侧的电极为负极
B.充电时,Li+向左移动
C.充电时,每转移1mol电子,石墨电极增重7g
D.放电时,正极反应式:xFePO4+xLi++xe-=xLiFePO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com