
科目: 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。AC2是非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子在外界。根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_________;
(2)B的氢化物的分子立体构型是_____;其中心原子采取_______杂化。
(3)写出化合物AC2的电子式为_______;一种由B、C组成的化合物与AC2互为等电子体,其化学式为______。
(4)E的核外电子排布式是______,ECl3形成的配合物的化学式为_____
查看答案和解析>>
科目: 来源: 题型:
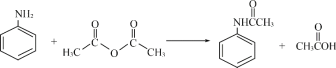
【题目】酰苯胺作为一种常用药,具有解热镇痛的效果。实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
密度(g/mL) | 相对分子质量 | 颜色、状态 | 溶解性 | |
苯胺 | 1.04 | 93 | 无色油状液体 | 微溶于水, 易溶于乙醇、乙醚 |
乙酸酐 | 1.08 | 102 | 无色透明液体 | 遇水缓慢反应生成乙酸 |
乙酰苯胺 | 135 | 无色片状晶体, 熔点 114℃ | 不溶于冷水,可溶于热 水、乙醇、乙醚 |
实验步骤
①取5.00mL苯胺,倒入 100mL锥形瓶中,加入20mL水,在旋摇下分批加入 6.00mL 乙酸酐,搅拌均匀。若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至 150mL 烧杯中,加入适量水配制成 80℃的饱和溶液,再加入过量 20%的水。稍冷后,加半匙活性炭,搅拌下将溶液煮沸 3~5min,趁热过滤,冷却结晶,抽滤、洗涤、晾干得乙酰苯胺纯品。
请回答:
(1)苯胺与冰醋酸反应制备乙酰苯胺的化学反应方程式______________________。
(2)反应温度过高会导致苯胺挥发,下列操作可控制反应温度,防止反应温度升高过快的是____________。
A.反应快结束时的充分搅拌 B.旋摇下分批加入 6.0mL 乙酸酐
C.玻璃棒将块状物研碎 D.加 20mL 水
(3)在步骤②中对粗产品进行洗涤可能需要用到以下操作:
a.加入洗涤剂至浸没固体;
b.洗涤剂缓慢通过;
c.洗涤剂快速通过;
d.关小水龙头;
e.开大水龙头;
f.重复 2~3 次。
请选出正确的操作并排序_____。(操作可重复使用)
(4)加入过量 20%的水的目的是_____。
(5)下列关于步骤③说法不正确的是__________________________。
A.活性炭吸附有色物质,可以提高产率
B.冷却时,冰水浴冷却比室温冷却更易得到大颗粒晶体便于抽滤
C.抽滤用如图装置,为防止倒吸,结束时可先关闭抽气泵,后打开活塞 a

D.洗涤完成后应将布氏漏斗从吸滤瓶上取下,左手握布氏漏斗,倒转,用右手“拍击”左手,使固体连同滤纸一起落入洁净的表面皿上,揭去滤纸,再对固体做晾干处理
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)下列是中学化学中熟悉的物质:
O2 金刚石 NaBr H2SO4 Na2CO3 Na2S NaHSO4
回答下列问题:
这些物质中,只含共价键的是________;只含离子键的是________;既含离子键又含共价键的是________。
(2)写出下列物质的电子式。
Na2O2:_________________;
NH4H:_______________________;
(3)写出下列物质的结构式。
CO2:____________________
H2O2:_______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物的结构简式如图所示,下列说法中不正确的是( )
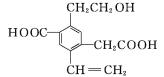
A.1 mol该有机物和过量的金属钠反应最多可以生成1.5 mol H2
B.该有机物最多消耗Na、NaOH、NaHCO3的物质的量之比为3∶2∶2
C.可以用酸性KMnO4溶液检验其中的碳碳双键
D.该有机物能够在催化剂作用下发生酯化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. CHCl3+HF → CHFCl2+HCl 属于取代反应
B. 煤气化生成 CO 和H2,再经过催化合成可以得到甲醇等液体燃料
C. 石油裂解气和SO2 都能使 KMnO4 溶液褪色,褪色原理不同
D. 苯在一定条件下能与H2 发生加成反应,也能与氯气发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2剧烈反应,放出大量的热; MgBr2 具有强吸水性;
②MgBr2 + 3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。

实验主要步骤如下:
步骤1:三颈烧瓶中装人10 g镁屑(镁带打磨光亮后剪碎)和
150 mL无水乙醚;仪器B中加入15 mL液溴,连接装置;,
步骤2:打开止水夹,缓慢通人干燥的氮气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出.晶体,过滤得三乙醚合溴化镁粗产品;
步骤4:用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至1609°C分解得无水MgBr2。
回答下列问题:
(1)MgBr2 的形成过程可用电子式表示为_____________
(2)仪器A的作用是_______;仪器B的名称是___________.实验前仪器A、B和三颈烧瓶内壁均需保持干燥,原因是__________________
(3)实验中,______________(填“能”或“不能”)用干燥空气代替干燥氮气,理由是___________。
(4)若去除冰水浴,三颈烧瓶中生成MgBr2的同时,可能会生成少量杂质X, 1 mol X含50 mol e-,其化学式为______________________________________________。
(5)步骤4采用减压过滤(降低容器内压强,使固液快速分离),下列装置可用作减压过滤的是________________________(填序号)。

(6)为测定产品的纯度(假定杂质不参与反应),可用EDTA (简写为Y4-,无色)标准溶液滴定,以络黑T为指示剂(pH=6.3~11.6时显蓝色,pH>11.6时显橙色)。已知: Mg2+与络黑T形成的配合物(Mg2+_络黑T)呈酒红色,Mg2+与Y4-形成的MgY2-为无色;在pH约为9的缓冲溶液中滴定,反应的离子方程式可简单表示为: Mg2+ + Y4-=MgY2-, Mg2+-络黑 T+Y4- =MgY2- +络黑T。
①判断滴定终点的现象为__________________.
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加人2滴络黑T试液作指示剂,用0. 0500 mol·L-1 EDTA标准溶液滴定至终点,重复三次滴定,平均消耗EDTA标准溶液26. 60 mL,则测得无水MgBr2产品的纯度是___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.

(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____

查看答案和解析>>
科目: 来源: 题型:
【题目】化合物DMPG是一种人工合成磷脂,是理想的药用脂质体辅料之一。其合成路线可设计如图所示:
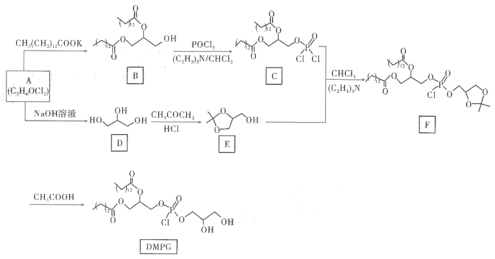
回答下列问题:
(1) D俗称甘油,其化学名称为_______;E的分子式为______,其官能团名称为______。
(2)A生成D的化学方程式为_______,反应类型为_____________。
(3)(C2H5)3N是一种有机碱,可推测其在B生成C、C与E生成F的反应中起到的作用是_____。
(4)X是E的同分异构体,写出符合下列条件的X的结构简式__________、_________。
①能发生银镜反应;②能与金属钠反应生成氢气,且n(X):n( H2) =1:1;③有五种不同化学环境的氢,个数比为4:3:2:2:1。
(5)已知CH3COCH3 (丙酮)与D生成E的反应历程为:
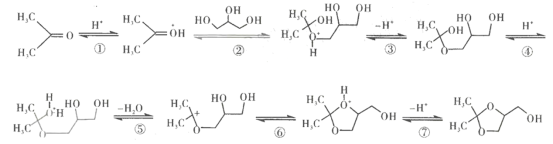
写出CH3COCH3与HOCH2CH2OH反应历程的第④~第⑦步:![]() ____________
____________
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答以下问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是_____,请写出溶液中VO3-转化为V2O74-的离子方程式:________________________。
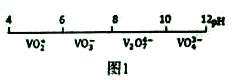
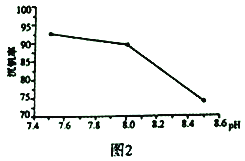
(2)“弱碱性铵盐沉钒法”原理是在含有钒元素的溶液中加入铵盐后形成NH4VO3沉淀,图2是在工业生产中不同pH环境下沉钒率的测定值。实际工业生产中常选择pH=7.5为沉钒的最佳条件,当pH超过8.0时沉钒率降低,其原因是溶液中VO3-转化为V2O74-、____________________________________。(请另写出一点原因)
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g) ![]() 2SO3(g) △H=p的催化剂,其催化原理如图3所示。
2SO3(g) △H=p的催化剂,其催化原理如图3所示。
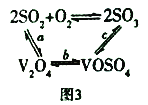
①过程a和过程b的化学方程式为:V2O5(s)+SO2(g)=V2O4(s)+SO3(g) △H = q;V2O4(s)+O2(g)+2SO2(g)=2VOSO4(s) △H = r 请写出过程c的热化学方程式:_________________。
②t2℃下,反应:2SO3(g) ![]() 2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。

t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】白铜是一种铜镍合金,为我国首先发明使用并传入世界各地,其发明在世界化学史和冶金史中都占有重要地位。白铜广泛用于造船、石油、化工、建筑、电力、精密仪表、医疗器械、乐器制作等部门作耐蚀的结构件。
(1)镍元素基态原子的电子排布式为______________,3d能级上的未成对电子数为______。
(2)单质铜、镍都是通过__________ 键形成晶体;比较元素铜与镍的第二电离能大小,I2(Cu)_____I2(Ni) (填“>”或“<”),原因是______________________。
(3)金属镍粉在CO气流中轻微加热,生成无色(或黄色)易挥发的液体Ni(CO)4。 写出一种与Ni(CO)4的配体互为等电子体的物质的分子式_____ ;推测Ni(CO)4的晶体类型是_______。呈正四面体构型的Ni( CO)4。易溶于下列物质中的______(填字母)。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(4)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为______该化合物的摩尔质量为M g●mol-1, NA代表阿伏加德罗常数的值。若该晶胞的边长为a pm,则该晶体的密度是_____g .cm-3。
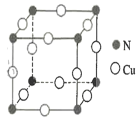
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com