
科目: 来源: 题型:
【题目】某化学兴趣小组为了测定某铁碳合金中铁的质量分数,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
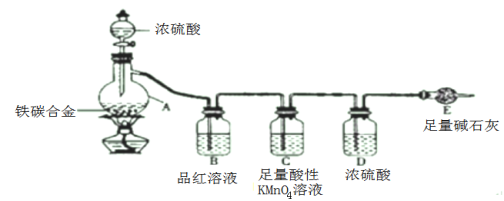
(1)按图示的连接装置,检查装置的气密性并称量E的质量。将10克铁碳合金样品放入A中,再加入适量的浓硫酸,仪器A的名称为_________________。未点燃酒精灯前,A、B均无明显现象 。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出A中浓硫酸参与反应的化学方程式 __________________(任写一个)。C装置的作用是 _____________ 。
(3)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重。E增重1.1克。则铁碳合金中铁的质量分数为 _________________ 。
(5)该装置存在一些缺陷,使得测定结果可能会产生误差,请指出该装置的缺陷__________ 、 __________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】用辉铜矿(主要成分为![]() ,含少量
,含少量![]() 、
、![]() 等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
等杂质)制备难溶于水的碱式碳酸铜的流程如图所示:
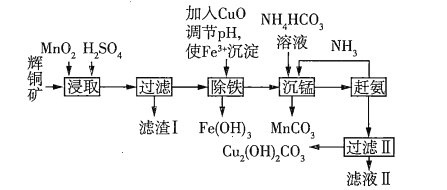
(1)下列措施无法加快浸取速率的是________(填字母)。
A.延长浸取时间 B.将辉铜矿粉碎 C.充分搅拌 D.适当增大硫酸浓度
(2)滤渣Ⅰ中的主要成分是![]() 、S、
、S、![]() ,请写出“浸取”反应中生成S的离子方程式:_________________________。
,请写出“浸取”反应中生成S的离子方程式:_________________________。
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,原因可能是__________________________。
(4)“沉锰”(除![]() )过程中有关反应的离子方程式为________________________________。
)过程中有关反应的离子方程式为________________________________。
(5)滤液Ⅱ经蒸发结晶得到的盐主要是___________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有研究人员在体外实验中发现药物瑞德西韦对新冠病毒有明显抑制作用。E是合成瑞德西韦的中间体,其合成路线如下:
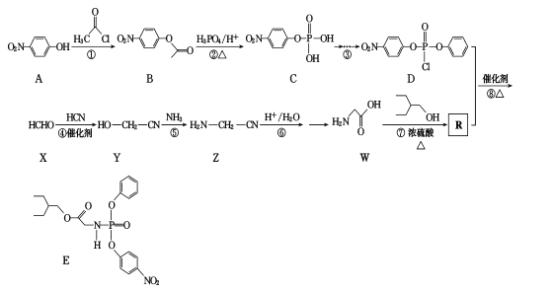
回答下列问题:
(1)W的化学名称为____;反应①的反应类型为____
(2)A中含氧官能团的名称为____。
(3)写出反应⑦的化学方程式_____
(4)满足下列条件的B的同分异构体有____种(不包括立体异构)。
①苯的二取代物且苯环上含有硝基;②可以发生水解反应。
上述同分异构体中核磁共振氢谱为3:2:2的结构简式为____________
(5)有机物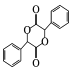 中手性碳(已知与4个不同的原子或原子团相连的碳原子称为手性碳)有 ___个。结合题给信息和已学知识,设计由苯甲醇为原料制备
中手性碳(已知与4个不同的原子或原子团相连的碳原子称为手性碳)有 ___个。结合题给信息和已学知识,设计由苯甲醇为原料制备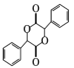 的合成路线_______ (无机试剂任选)。
的合成路线_______ (无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)汽车尾气脱硝脱碳主要原理为2NO(g) + 2CO(g)![]() N2(g) + 2CO2(g) ΔH <0。
N2(g) + 2CO2(g) ΔH <0。
①该反应在______(填“低温”或“高温”)下可自发反应。
②一定条件下的密闭容器中,充入10 mol CO和8 mol NO, 发生上述反应,如图为平衡时NO的体积分数与温度、压强的关系。

Ⅰ.该反应达到平衡后,为在提高反应速率同时提高NO的转化率,可采取的措施有______(填字母序号)。
a.缩小容器的体积 b.改用高效催化剂
c.升高温度 d.增加CO的浓度
Ⅱ.压强为10 MPa、温度为T1下,若反应进行到30 min达到平衡状态,容器的体积为4L,该温度下平衡常数Kp=______(压强以MPa为单位进行计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留两位有效数字)。
③氨气易溶于水可电离出 NH4+和 OH-、易液化,液氨也与水一样发生微弱的双聚电离,但比水弱,能溶解一些金属等性质。下列说法中不正确的是_______
a.NH3 可看作比水弱的电解质
b.NH3 的双聚电离可表示为:2NH3![]() NH4++NH2-
NH4++NH2-
c.NH3 易溶于水是由于与水形成氢键
d.NH3 可与Na 反应: 2NH3+2Na=2NaNH2+H2↑
(2)冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。用活性炭处理工厂尾气中的氮氧化物。
①已知:Ⅰ. 4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1=a kJ·mol-1
Ⅱ. 4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=b kJ·mol-1
Ⅲ. C(s)+O2(g)=CO2(g) ΔH3=c kJ·mol-1
则反应C(s)+2NO(g) ![]() N2(g)+CO2(g)的ΔH =_____ kJ·mol-1(用a、 b 、c表示)。
N2(g)+CO2(g)的ΔH =_____ kJ·mol-1(用a、 b 、c表示)。
②在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图所示,下列说法正确的是______。
N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图所示,下列说法正确的是______。
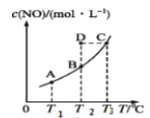
a.其他条件不变,容器内压强不再改变时,反应达到平衡状态
b.温度为T2时,若反应体系处于状态D,则此时v正>v逆
c.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
d.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
③已知某温度时,反应C(s)+2NO(g) ![]() N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图中画出反应过程中c(NO)随时间t的变化曲线。
N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图中画出反应过程中c(NO)随时间t的变化曲线。
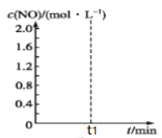 ____________
____________
④工业上实际处理废气时,常用活性炭作催化剂,用NH3还原NO,同时通入一定量的O2以提高处理效果。当n(NH3)=n(NO)时,写出体系中总反应的化学方程式:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有学生将铜与稀硝酸反应实验及NO、NO2性质实验进行改进、整合,装置如图(洗耳球:一种橡胶为材质的工具仪器)。

实验步骤如下:
(一)组装仪器:按照如图装置连接好仪器,关闭所有止水夹;
(二)加入药品:在装置A中的烧杯中加入30%的氢氧化钠溶液,连接好铜丝,在装置C的U型管中加入4.0 mol/L的硝酸,排除U型管左端管内空气;
(三)发生反应:将铜丝向下移动,在硝酸与铜丝接触时可以看到螺旋状铜丝与稀硝酸反应产生气泡,此时打开止水夹①,U型管左端有无色气体产生,硝酸左边液面下降与铜丝脱离接触,反应停止;进行适当的操作,使装置C中产生的气体进入装置B的广口瓶中,气体变为红棕色;
(四)尾气处理:气体进入烧杯中与氢氧化钠溶液反应;
(五)实验再重复进行。
回答下列问题:
(1)实验中要保证装置气密性良好,检验其气密性操作应该在____。
a.步骤(一)(二)之间 b.步骤(二)(三)之间
(2)装置A的烧杯中玻璃仪器的名称是____。
(3)加入稀硝酸,排除U型管左端管内空气的操作是________。
(4)步骤(三)中“进行适当的操作”是打开止水夹____(填写序号),并用洗耳球在U型管右端导管口挤压空气进入。
(5)在尾气处理阶段,使B中广口瓶内气体进入烧杯中的操作是____。尾气中主要含有NO2和空气,与NaOH溶液反应只生成一种盐,则离子方程式为 ___。
(6)某同学发现,本实验结束后硝酸还有很多剩余,请你改进实验,使能达到预期实验目的,反应结束后硝酸的剩余量尽可能较少,你的改进是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某镁铝合金MgxAly(其中x、y为整数)是贮氢材料,可在通入氩气的条件下,将一定化学计量比的Al、Mg单质在一定温度下熔炼制得.为测定该合金的成分,称取一定质量的样品放入600mL稀硫酸中,样品全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示.完成下列问题:
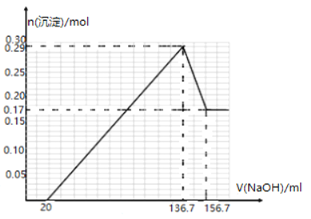
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是_____________。
(2)NaOH溶液的物质的量浓度为____________。
(3)该镁铝合金(MgxAly)的化学式为_____________。
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1,得到的混合物在6.0mol·L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为__________________。
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应_____________________。
(6)如图甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是_________________。
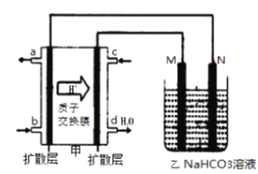
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素的原子序数依次增大,元素A的某种核素无中子,B元素的最高正价与最低负价代数和为2,C元素和E元素同主族,且E元素的最高价含氧酸为二元强酸,D元素是同周期元素中离子半径最小的元素。请回答下列问题:
(1)A和B元素组成的化合物B2A4的电子式为 _______________。
(2)D的最高价氧化物和F的最高价含氧酸反应的离子方程式________________________。
(3)C元素和E元素的最低价氢化物的沸点C __________E(填大于或小于),理由_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在生产生活中应用广泛。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领。氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的外围电子排布式____;基态铬、氮原子的核外未成对电子数之比为____。
(2)氮化铬的晶体结构类型与氯化钠相同,但氮化铬熔点(1282℃)比氯化钠 (801'C)的高,主要原因是________。
(3)过硫酸铵[(NH4)2S2O8],广泛地用于蓄电池工业、石油开采、淀粉加工、油脂工业、照相工业等,过硫酸铵中N、S、O的第一电离能由大到小的顺序为 _______,其中NH4+的空间构型为____________
(4)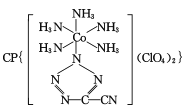 是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由
是20世纪80年代美国研制的典型钝感起爆药Ⅲ,它是由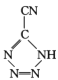 和[Co(NH3)5H2O](ClO4)3反应合成的,
和[Co(NH3)5H2O](ClO4)3反应合成的,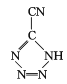 中孤电子对与π键比值为 _______, CP的中心Co3+的配位数为 ______ 。
中孤电子对与π键比值为 _______, CP的中心Co3+的配位数为 ______ 。
(5)铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力,有望获得较高的微波磁导率,具有极大的市场潜力,其四子格结构如图所示,已知晶体密度为ρgcm-3,阿伏加德罗常数为NA。
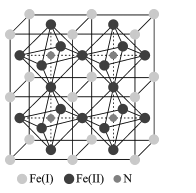
①写出氮化铁中铁的堆积方式为____。
②该化合物的化学式为 ___。
③计算出 Fe(II)围成的八面体的体积为____cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-为了确定该溶液的组成,某同学取上述溶液X,进行了如下实验:
(1)向一定量溶液X加入少量氯水,然后滴加淀粉溶液,未显蓝色;
(2)另取100毫升溶液X再加入足量氯水,然后滴加足量BaCl2溶液,得到沉淀6.99g;
(3)将上述(2)的反应混合液过滤,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为2.24L。
根据上述实验,以下推测正确的是
A.原溶液可能存在Na +、Fe3+、SO42-
B.原溶液一定存在NH4+、I-
C.原溶液一定不含Ba2+、Fe3+、I-
D.另取X试液滴加足量盐酸酸化的BaCl2溶液,即可确定溶液所有的离子组成
查看答案和解析>>
科目: 来源: 题型:
【题目】CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
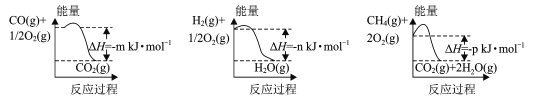
CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式 ___________。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:
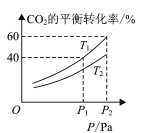
①反应过程中,表明反应达到平衡状态的标志是______;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1 ___T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___(不必化简,可以不带单位)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com