
科目: 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
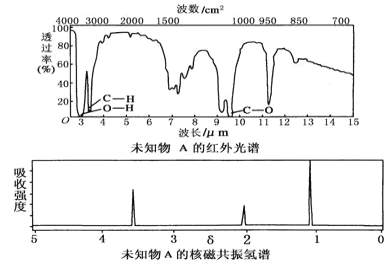
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关说法正确的是
A.MgO(s)+C(s)=CO(g)+Mg(g)高温下能自发进行,则该反应ΔH>0、ΔS>0
B.常温下等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C.0.1 mol·L-1 NH4Cl溶液加水稀释,![]() 的值增大
的值增大
D.对于反应2SO2+O22SO3,使用催化剂能加快反应速率并提高SO2的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A.用向上排空气法收集NO
B.用装置甲配制100 mL 0.100 mol·L-1的硫酸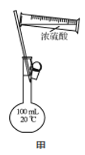
C.用装置乙蒸发CuCl2溶液可得到CuCl2固体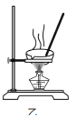
D.向含少量水的乙醇中加入生石灰后蒸馏可得到无水乙醇
查看答案和解析>>
科目: 来源: 题型:
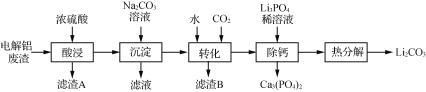
【题目】Li2CO3是生产锂电池的重要原料,电解铝废渣(主要含AlF3、LiF、NaF、CaO等物质)可用于制备Li2CO3。
已知:①Li2CO3的溶解度:0 ℃ 1.54 g;20 ℃ 1.33 g;80 ℃ 0.85 g。
②20 ℃,Ksp[Ca3(PO4)2]=2×10-33,Ksp(CaHPO4)=1×10-7。
(1)在加热条件下酸浸,反应生成能腐蚀玻璃的气体,写出AlF3发生反应的化学方程式:______。

(2)滤渣B的主要成分是________。
(3)“转化”后所得LiHCO3溶液中含有的Ca2+需要加入Li3PO4除去。除钙步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如右图所示。
①随着温度升高最终Li2CO3的产率逐渐减小的原因是___________。
②当温度高于50 ℃时,除钙率下降的原因可能是__________________。
(4)热分解后,获得Li2CO3需趁热过滤的原因是_______________________。
(5)将酸浸时产生的气体通入Al(OH)3和Na2SO4溶液的混合物中可产生难溶物冰晶石(Na3AlF6),该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁铵(NH4Fe(SO4)2·xH2O)是一种重要铁盐,为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁氨,具体流程如下:

(1)步骤②需要加热的目的是_______________
(2)步骤②温度保持80-95℃,采用的合适加热方式是_____________________
(3)步骤③加入5%H2O2的目的是将Fe2+全部氧化为Fe3+,不引入杂质,请写出反应的离子方程式__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如下物质的转化关系图,回答有关问题:
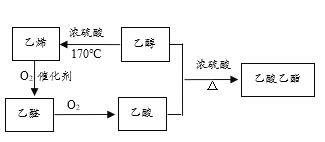
(1)上述物质中,_________(填结构简式,下同)的产量是衡量一个国家石油化工发展水平的标志;常见的酸性调味品中含有3%~5%的_________;具有香味的油状液体是_____________。
(2)乙醇中![]() 官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
官能团名称是______,比乙醇少一个碳原子的同系物的结构简式是______。
(3)生成乙酸乙酯的化学方程式是__________________________。
查看答案和解析>>
科目: 来源: 题型:
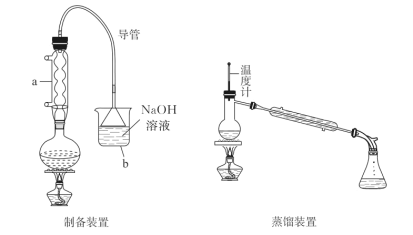
【题目】正溴丁烷是稀有元素萃取的溶剂及有机合成的中间体,其制备如图(夹持装置略):
已知:i.NaBr+H2SO4(浓)=HBr↑+NaHSO4
ii.CH3CH2CH2CH2OH十HBr→CH3CH2CH2CH2Br+H2O
iii.2HBr+H2SO4![]() Br2+SO2+2H2O
Br2+SO2+2H2O
iv.正溴丁烷密度:1.27g·mL-1;浓硫酸密度:1.84g·mL-1
请回答下列问题:
(1)正溴丁烷粗产品的制备:
①仪器a的名称是__,向圆底烧瓶中添加药品顺序正确的是__(填正确选项字母)。
A.浓H2SO4→适量水→正丁醇→溴化钠粉末
B.适量水→浓H2SO4→正丁醇→溴化钠粉末
C.适量水→正丁醇→浓H2SO4→溴化钠粉末
D.适量水→正丁醇→溴化钠粉末→浓H2SO4
②装置b中装入NaOH溶液,目的是__。
③加热回流,在此期间要不断地摇动反应装置,其原因为__;冷却后改为蒸馏装置,蒸出其正溴丁烷的粗品。
(2)正溴丁烷的提纯:
①把正溴丁烷粗品倒入分液漏斗中,加入适量水洗涤,分出有机层;
②在另一干燥的分液漏斗中,加入浓硫酸洗去有机层中少量的未反应的正丁醇及副产物,从__(选填“上口”或“下口”)分出有机层;
③有机层依次用适量的水、浓硫酸、水、饱和NaHCO3溶液、水洗涤,用无水CaCl2干燥。以上三次用水洗涤简化为一次用水洗涤是否合理,并说明理由__。
(3)①若洗涤后产物有红色,说明含有溴单质,应加入适量的饱和NaHSO3溶液洗涤,将溴单质全部除去,其反应的离子方程式为__。
②若投入正丁醇11.84g,得到产物12.50g。则正丁醇的转化率为__(保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以A、B、C为原料制取药物AspirinSustained-ReleaseTablets(缓释阿司匹林)的合成路线如图:

已知:ⅰ.A、B为烃,其中A的产量可作为石油化工水平的标志;
ⅱ. 。
。
回答下列问题:
(1)Z所含官能团名称为___。
(2)B和Y的结构简式为__、__。
(3)完成方程式:
①X→CH2OHCH2OH__。
②C→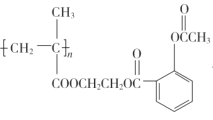 __。
__。
(4)满足以下条件的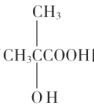 的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
a.能发生水解反应 b.能与钠反应放出氢气 c.能发生银镜反应
(5)以乳酸(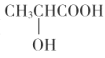 )和甲醇为原料,其他无机试剂任选,设计合成
)和甲醇为原料,其他无机试剂任选,设计合成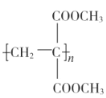 的路线:__。
的路线:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如下图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B.C两元素的核电荷数之和是A元素原子序数的4倍。下列说法正确的是
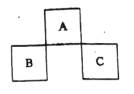
A.C位于元素周期表中第3周期第VA族
B.B的非金属性比A强
C.C的气态氢化物的稳定性比B的强
D.原子半径:r(B)<r(C)
查看答案和解析>>
科目: 来源: 题型:
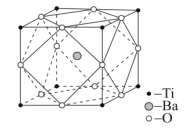
【题目】钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业上以TiCl4、BaCO3、H2C2O4等物质为原料制备草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],再高温煅烧制得钛酸钡粉体。请回答下列问题:
(1)基态Ti原子的价电子排布图为__,同周期元素中,基态原子未成对电子数与Ti相同的元素有___(填元素符号)。
(2)第IIA族(碱土金属)元素的原子序数、原子半径、第一电离势(从元素的气态基态原子中将一个电子移至无穷远处时所需做的功)如下表所示。
元素 | 原子序数 | 原子半径/pm | 每一电离势/eV |
Be | 4 | 89 | 9.32 |
Mg | 12 | 136 | 7.644 |
Ca | 20 | 174 | 6.111 |
Sr | 38 | 191 | 5.692 |
Ba | 56 | 198 | 5.21 |
①由上表数据可知,相邻元素原子半径差值r(Be-Mg)、r(Mg-Ca)明显大于r(Ca-Sr)、r(Sr-Ba),试解释其原因__。
②由上表数据可知,随原子序数的递增,第IIA族元素的第一电离势依次减小,试解释其原因__。
(3)已知草酸分子的结构简式为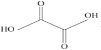 。
。
①草酸分子中,碳原子的杂化方式为__。
②由此结构简式可预测草酸__(填“难溶”“微溶”或“易溶”)于水和乙醇。
③已知草酸和液溴的相关数据如下,草酸熔点高于液溴的原因是__。
名称 | 化学式 | 相对子质量 | 熔点 |
草酸 | H2C2O4 | 90 | 101℃ |
液溴 | Br2 | 160 | -7.2℃ |
(4)设NA是阿伏加德罗常数的值,已知钛酸钡的立方晶胞结构如图所示,晶胞中Ti原子的配位数为__,其晶胞参数约为apm,钛酸钡晶体的密度ρ=__g.cm-3。(列式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com