
科目: 来源: 题型:
【题目】我国某科研团队以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料,制取高纯碳酸锰,工艺流程如下图:
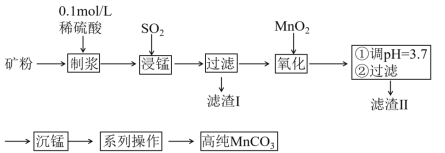
(1)对矿石进行粉粹的目的是_______;
(2)滤渣Ⅰ、Ⅱ分别为________、________;
(3)采用1%稀硫酸而不采用水混合矿粉制浆的原因是_________;不采用较浓H2SO4的原因是______;不直接采用H2SO4浸锰的原因是___________。
(4)浸锰的离子方程式为____________;
(5)“系列操作”为过滤、_________、干燥。
(6)取所得的高纯MnCO311.7g溶于足量的盐酸中,将产生的气体用足量的Ba(OH)2浓溶液吸收,得到白色沉淀19.7g,则所得产品的纯度为________%(保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B都是短周期元素,原子最外层电子排布式分别为![]() 。A与B可形成化合物C和D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题。
。A与B可形成化合物C和D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题。
(1)比较电离能:
①![]() _____
_____ ![]() (填“>”或“<”,下同)
(填“>”或“<”,下同)
②![]() _____
_____ ![]() 。
。
(2)通常A元素的化合价是 _____________ ,对A元素呈现这种价态进行解释:
①用原子结构的观点进行解释:_____________ 。
②用电离能的观点进行解释:______________ 。
(3)写出D跟水反应的离子方程式: _________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】喹啉(![]() )是治疗新冠肺炎的药物氯喹的基础原料,其合成路线如下:
)是治疗新冠肺炎的药物氯喹的基础原料,其合成路线如下:
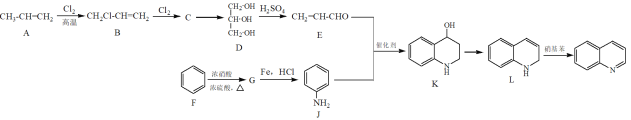
下列有关说法正确的是
A.C→D的反应条件为NaOH水溶液,加热
B.可以用溴水来检验化合物E中的碳碳双键
C.F→G和G→J的反应类型分别为取代反应和还原反应
D.与喹啉互为同分异构体,且含有碳碳双键和氰基(-CN)的芳香族化合物共有4种
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O;以CO、O2、NH3为原料,可合成尿素[CO(NH2)2]。下列叙述错误的是
CH3CH2OH+H2O;以CO、O2、NH3为原料,可合成尿素[CO(NH2)2]。下列叙述错误的是
A.H2O分子VSEPR模型为V形
B.CH3CH2OH分子中亚甲基(-CH2-)上的C原子的杂化形式为sp3
C.在上述涉及的4种物质中,沸点从低到高的顺序为H2<CO< H2O<CH3CH2OH
D.CO(NH2)2分子中含有的σ键与π键的数目之比为7:1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,Ka(CH3COOH)=1.8×10-5,分别向20 mL 0.1 mol/L NaHCO3溶液和CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,滴定曲线如图所示。下列叙述正确的是
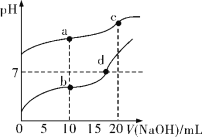
A.b点溶液中粒子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(CH3COOH)>c(OH-)
B.c点溶液中存在:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
C.溶液中由水电离出c(H+)大小关系:b<d<a=c
D.d点溶液中: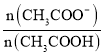 =180
=180
查看答案和解析>>
科目: 来源: 题型:
【题目】已知元素的电负性和原子半径一样,也是元素的基本性质。下表给出14种元素的电负性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
试结合元素周期律相关知识完成下列问题。
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是__________ (从电负性与结构的关系考虑)。
(2)请预测Br与I元素电负性的大小关系:_________ 。
(3)经验规律告诉我们:当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键,而小于1.7时,一般为共价键。试推断![]() 中化学键的类型是 ___________
中化学键的类型是 ___________
(4)预测元素周期表中电负性最小的元素是_____ (放射性元素除外)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中充入5 mol CO和4 mol NO,发生反应: 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,图1为平衡时NO的体积分数与温度、压强的关系。同时为探究催化剂对CO、NO转化率的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。下列说法中正确的是
N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,图1为平衡时NO的体积分数与温度、压强的关系。同时为探究催化剂对CO、NO转化率的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示。下列说法中正确的是
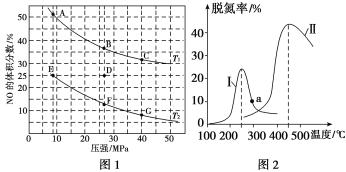
A.温度:T1<T2
B.若在D点对反应容器降温的同时缩小体积使体系压强增大,重新达到的平衡状态可能是图中G点
C.E点时NO的平衡转化率为50%
D.a点是对应温度下的平衡脱氮率
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是原子序数为1~19的元素第一电离能的变化曲线(其中部分元素第一电离能已经标出数据)。结合元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列有关问题。
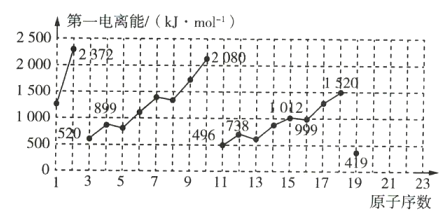
(1)碱金属元素中Li、Na、K的第一电离能分别为 _____________ ![]() 、 _____________
、 _____________ ![]() 、 _____________
、 _____________ ![]() 。
。
(2)同主族中不同元素的第一电离能变化的规律为: _____________ ,碱金属元素这一变化的规律与碱金属的活泼性的关系是 _____________ 。
(3)钙元素的第一电离能的数值范围为 _____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
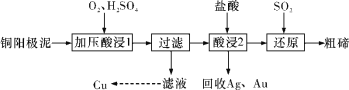
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。下列说法错误的是
A.“加压酸浸1”过程中将碲元素转化成TeO2,应严格控制溶液的pH值
B.“酸浸2”过程中温度不能过高,否则会使碲的浸出率降低
C.从Ag和Au中分离出Au,应该向回收的Ag和Au中加入稀氨水
D.“还原”反应中发生的离子方程式为:TeO2+2SO2+2H2O=Te+2SO42-+4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】开发新型储氢材料是开发利用氢能的重要研究方向。
(1)![]() 是一种储氢材料,可由
是一种储氢材料,可由![]() 和
和![]() 反应制得。
反应制得。
①基态Cl原子中,电子占据的最高电子层符号为 _______,该电子层具有的原子轨道数为 _______。
②Li、B、H元素的电负性由大到小的排列顺序为 ___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+ ___________(填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
|
|
|
|
|
738 | 1451 | 7733 | 10540 | 13630 |
则M是 ______________ (填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com