
科目: 来源: 题型:
【题目】白藜芦醇在保健品领域有广泛的应用。其合成路线如下:
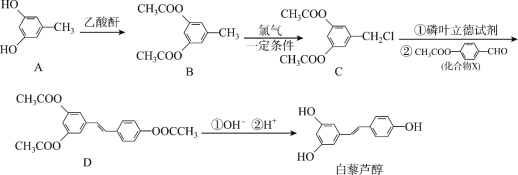
回答下列问题:
(1)物质B中含氧官能团的名_______。B→C的反应类型为___________。
(2)1mol有机物D最多能消耗NaOH为 _________mol,白藜芦醇遇足量浓溴水时反应的化学方程式为____________。
(3)已知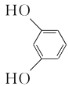 的系统名称1,3-苯二酚,则A的名称为________,已知乙酸酐(
的系统名称1,3-苯二酚,则A的名称为________,已知乙酸酐(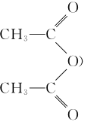 )极易与水反应生成乙酸,是很好的吸水剂。试从平衡移动的角度分析A→B反应中用乙酸酐代替乙酸的目的是__________。
)极易与水反应生成乙酸,是很好的吸水剂。试从平衡移动的角度分析A→B反应中用乙酸酐代替乙酸的目的是__________。
(4)C的核磁共振氢谱有_________组峰,写出满足下列条件的化合物X的所有同分异构体的结构简式__________。
①具有与X相同的官能团②属于醋酸酯
(5)利用甲苯、磷叶立德试剂和乙醛为原料可以合成![]() (涉及无机试剂自选),请写出合成路线__________。
(涉及无机试剂自选),请写出合成路线__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】肉桂酸(![]() )是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
)是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 水中溶解度(25℃) |
苯甲醛 | 106 | -26 | 179.62 | 微溶 |
聚苯乙烯 | 104n | 83.1~105 | 240.6 | 难溶 |
肉桂酸 | 148 | 135 | 300 | 微溶(热水中易溶) |
实验室提纯肉桂酸的步骤及装置如下(部分装置未画出),试回答相关问题:
2g粗产品和30mL热水的混合物![]()
![]() 滤液
滤液![]()
![]() 称重
称重
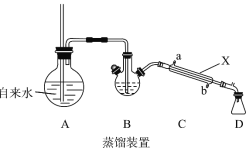
(1)装置A中长玻璃导管的作用是_________,步骤①使苯甲醛 随水蒸汽离开母液,上述装置中两处需要加热的仪器是____________(用字母 A、B、C、D回答)。
(2)仪器X的名称是_______,该装置中冷水应从___________口(填a或b)通入。
(3)步骤②中,10%NaOH溶液的作用是___________,以便过滤除去聚苯乙烯杂质。
(4)步骤④中,证明洗涤干净的最佳方法是________,若产品中还混有少量NaCl,进一步提纯获得肉桂酸晶体方法为_________________。
(5)若本实验肉桂酸粗产品中有各种杂质50%,加碱溶解时损失肉桂酸10%,结束时称重得到产品0.6g,若不计操作损失,则加盐酸反应的产率约为_____%(结果精确至0.1%)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫及其化合物具有一定的空间结构。
(1)S单质的常见形式为![]() ,其环状结构如图所示,S原子之间以单键相连,则S原子采取的杂化轨道方式是__________。
,其环状结构如图所示,S原子之间以单键相连,则S原子采取的杂化轨道方式是__________。

(2)气态![]() 分子的立体构型为__________;
分子的立体构型为__________;![]() 的立体构型为__________。
的立体构型为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①在T℃下,0~2s时,该反应的平均反应速率![]() =________;
=________;
②该温度下反应的平衡常数K=________,在T℃下,能提高NO的平衡转化率的措施有_______、________。
(3)已知NO和O2反应的历程如图,回答下列问题:
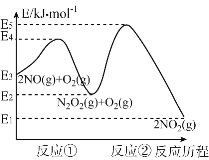
①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____(选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向1.00L浓度均为0.0100mol/L的Na2SO3、NaOH 混合溶液中通入HCl气体调节溶液pH(忽略溶液体积变化)。其中比H2SO3、HSO3-、SO32-平衡时的分布系数(各含硫物种的浓度与含硫物种总浓度的比)随HCl气体体积(标况下)的变化关系如图所示(忽略SO2气体的逸出);已知Ka1代表H2SO3在该实验条件下的一级电离常数。下列说法正确的是
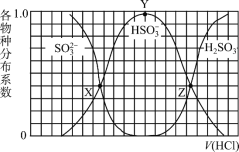
A.Z点处的pH=-lgKa1(H2SO3)
B.从X点到Y点发生的主要反应为SO32- +H2OHSO3- +OH-
C.当V(HCl)≥672mL时,c(HSO3-) = c(SO32-)=0mol/L
D.若将HCl改为NO2,Y点对应位置不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关乙烯和苯分子中的化学键描述正确的是( )
A.苯分子中每个碳原子的![]() 杂化轨道中的其中一个形成大
杂化轨道中的其中一个形成大![]() 键
键
B.乙烯分子中![]() 键是
键是![]() 杂化轨道形成的
杂化轨道形成的![]() 键
键![]() 键是未参加杂化的
键是未参加杂化的![]() 轨道形成的
轨道形成的![]() 键
键
C.苯分子中碳碳键是![]() 杂化轨道形成的
杂化轨道形成的![]() 键,
键,![]() 键是未参加杂化的
键是未参加杂化的![]() 轨道形成的
轨道形成的![]() 键
键
D.乙烯和苯分子中每个碳原子都以![]() 杂化轨道形成
杂化轨道形成![]() 键,未杂化的
键,未杂化的![]() 轨道形成
轨道形成![]() 键
键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关苯分子的说法不正确的是( )
A.苯分子中![]() 原子采用
原子采用![]() 杂化,形成夹角为
杂化,形成夹角为![]() 的三个
的三个![]() 杂化轨道
杂化轨道
B.每个碳原子有一个与碳环平面垂直的未参与杂化的![]() 轨道,以“肩并肩”方式相互重叠,形成大
轨道,以“肩并肩”方式相互重叠,形成大![]() 键
键
C.苯分子中最多有六个原子共面,六个碳碳键完全相同
D.苯分子中的大![]() 键可表示为
键可表示为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下反应:Fe3++AgFe2++Ag+的平衡常数K=0.3。现将含0.010mol/LFe(NO3)2和0.10mol/L Fe(NO3)3的混合溶液倒入烧杯甲中,将含0.10mol/L的AgNO3溶液倒入烧杯乙中(如图),闭合开关 K,关于该原电池的说法正确的是
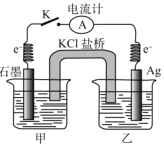
A.原电池发生的总反应中Ag+氧化Fe2+
B.盐桥中阳离子从左往右作定向移动
C.石墨为负极,电极反应为Fe2+-e-= Fe3+
D.当电流计指针归零时,总反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列四种晶体的晶胞示意图回答问题:
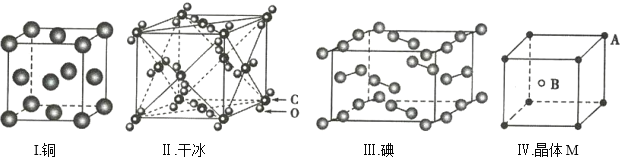
(1)根据图I分析,铜晶胞平均含有的铜原子数是___________。
(2)根据图Ⅱ分析,干冰晶胞平均含有的CO2分子数是___________。
(3)根据图Ⅲ分析,碘晶体中碘分子的排列有种不同的方向_________种不同的方向。
(4)根据图Ⅳ分析,晶体M的化学式可能是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com