
科目: 来源: 题型:
【题目】有X、Y、Z、Q、E、M、G原子序数依次增大的七种元素,除G元素外其余均为短周期主族元素。X元素原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为![]() ,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为
,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为![]() 。回答下列问题:
。回答下列问题:
(1)写出第3周期基态原子未成对电子数与G的相同且电负性最大的元素: ___________ (填元素名称)。GQ受热分解生成![]() 和
和![]() ,请从G的原子结构来说明
,请从G的原子结构来说明![]() 受热易分解的原因: ______ 。
受热易分解的原因: ______ 。
(2) Z、Q、M三种元素的第一电离能由大到小的顺序为 _________ (用元素符号表示)。
(3) Y与Q形成原子个数比为1:2的化合物的电子式为 _________ 。
(4) Z、M、E所形成的简单离子的半径由大到小的顺序为 __________ (用离子符号表示)。
(5) X、Y、Z、Q的电负性由大到小的顺序为 _______ (用元素符号表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有部分前36号元素的性质或原子结构信息如下表:
元素编号 | 元素的性质或原子结构 |
R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
S | 单质能与水剧烈反应,所得溶液a弱酸性 |
T | 基态原子3d轨道上有1个电子 |
X |
|
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是______。
(2)S元素的常见化合价为_______,原因是_______。
(3)T元素的原子N电子层上的电子数为____________。
(4)X的轨道表示式违背了____________。用X单质、碱金属盐等可以制作焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A元素原子最外层p能级的电子数等于次外层的电子总数,C元素原子最外层中有2个未成对电子。已知C、D、E元素原子核内的质子数均与中子数相等,且C元素可分别与A、B、D、E生成![]() 型化合物,在
型化合物,在![]() 中,D与C的质量比为7:8,在
中,D与C的质量比为7:8,在![]() 中,E与C的质量比为1:1。
中,E与C的质量比为1:1。
请回答下列问题:
(1)写出A、E两种元素的元素符号:A ____________ 、E ____________ 。
(2)写出D元素原子的核外电子排布式: ____________ 。
(3)指出E在元素周期表中的位置: ____________ 。
(4)比较A、B、C三种元素的第一电离能的大小: ____________ (填元素符号,下同)。
(5)比较D元素和E元素的电负性的相对大小: ____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是s能级和p能级的原子轨道示意图,试回答下列问题:
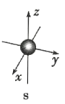
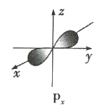
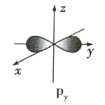
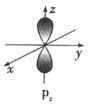
(1)若元素X的原子最外层电子排布式为![]() ,原子中能量最高的是 ____________ 电子,其电子云在空间内有 ____________ 个互相垂直的伸展方向;元素X的名称是 ____________ ,它的简单氢化物的电子式是 ____________ 。
,原子中能量最高的是 ____________ 电子,其电子云在空间内有 ____________ 个互相垂直的伸展方向;元素X的名称是 ____________ ,它的简单氢化物的电子式是 ____________ 。
(2)若元素X的原子最外层电子排布式为![]() ,那么X的元素符号为 ____________ ,原子的轨道表示式为 ____________ 。
,那么X的元素符号为 ____________ ,原子的轨道表示式为 ____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组设计实验探究H2S的性质,装置如图所示。

下列说法正确的是( )
A. 若F中产生黑色沉淀,则说明H2SO4的酸性比H2S强
B. 若G中产生浅黄色沉淀,则说明H2S的还原性比Fe2+强
C. 若H中溶液变红色,则说明H2S是二元弱酸
D. 若E中FeS换成Na2S,该装置也可达到相同的目的
查看答案和解析>>
科目: 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子的轨道表示式是 ________ 。
,其外围电子的轨道表示式是 ________ 。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是 _______ ,在元素周期表中的位置是 _______ 。
(3)C元素基态原子的轨道表示式是下图中的 ____________ (填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合 ____________ (填序号)。
①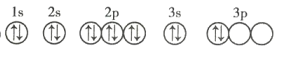
②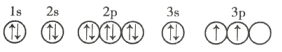
A 能量最低原则 B 泡利不相容原理 C 洪特规则
(4)元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能a叫作第一电离能(设为E)。第三周期元素的第一电离能示意图如图所示:
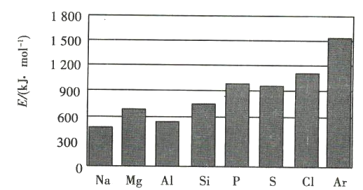
①同周期内,随着原子序数的增大,E值变化的总趋势是 ____________ ;
②根据图中提供的信息,可推断出E氧 ______ E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁 ____________ E钙。
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z、R是原子序数依次增大的短周期元素。a、b、c、d、e、f是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,f是由W、Z、R元素形成的化合物。m为元素Z形成的单质,W与X能形成化合物XW4。上述物质的转化关系如图所示,下列说法正确的是( )
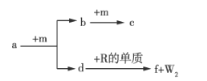
A.简单离子半径: R>Z
B.最高价氧化物对应水化物的酸性:X>Y
C.![]() 为离子化合物,含有离子键和共价键
为离子化合物,含有离子键和共价键
D.符合通式XnWn的化合物均能使溴的CCl4溶液因发生反应而褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如图所示,甲装置能将H2O和CO2转化为C6H12O6和O2,X、Y是特殊催化剂型电极,乙装置为甲醇—空气燃料电池。下列说法不正确的是

A.b口通入空气,c口通入甲醇
B.甲装置中H+向X极移动,乙装置中H+向M极移动
C.理论上,每生成22.4LO2(标况下),必有4mol电子由N极移向X极
D.阳极上的电极反应式为6CO2 + 24H+ + 24e- = C6H12O6 + 6H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列说法正确的是( )
A.基态R原子的轨道表示式为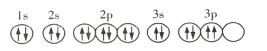
B.![]() 与
与![]() 的半径大小关系为
的半径大小关系为![]()
C.Y的第一电离能大于X的第一电离能
D.X、Y、Z、R、W中,电负性最大的元素为W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com