
科目: 来源: 题型:
【题目】食品加工中常用焦亚硫酸钠(Na2S2O5)作漂白剂、防腐剂和疏松剂。现实验室欲制备焦亚硫酸钠,其反应依次为:(ⅰ)2NaOH+SO2=Na2SO3+H2O;
(ⅱ)Na2SO3+H2O+SO2=2NaHSO3;
(ⅲ)2NaHSO3![]() Na2S2O5+H2O。
Na2S2O5+H2O。
查阅资料:焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。
实验装置如下:
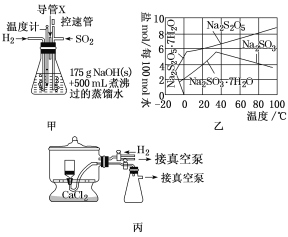
(1)实验室可用废铝丝与NaOH溶液制取H2,其离子方程式为___。
(2)通氢气一段时间后,以恒定速率通入SO2,开始的一段时间溶液温度迅速升高,随后温度缓慢变化,溶液开始逐渐变黄。“温度迅速升高”的原因为__。实验后期须利用水浴使温度保持在约80℃。
(3)反应后的体系中有少量白色亚硫酸钠析出,除去其中亚硫酸钠固体的方法是___;然后获得较纯的无水Na2S2O5,应将溶液冷却到30℃左右过滤,控制“30℃左右”的理由是___。
(4)丙为真空干燥Na2S2O5晶体的装置,通入H2的目的是___。
(5)常用剩余碘量法测定产品中焦亚硫酸钠的质量分数。已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+;2S2O32-+I2=S4O62-+2I-。请补充实验步骤(可提供的试剂有:焦亚硫酸钠样品、标准碘溶液、淀粉溶液、酚酞溶液、标准Na2S2O3溶液及蒸馏水)。
①精确称取产品0.2000g放入碘量瓶(带磨口塞的锥形瓶)中。
②准确移取一定体积的已知浓度的标准碘溶液(过量)并记录数据,在暗处放置5min,然后加入5mL冰醋酸及适量的蒸馏水。
③用标准Na2S2O3溶液滴定至接近终点。
④___。
⑤重复步骤①~③;根据相关记录数据计算出平均值。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有烃的含氧衍生物A(A分子中只有一种官能团),还原A时形成醇B,氧化A时形成酸C。由B、C反应可生成高分子化合物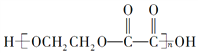 ,下列叙述中错误的是( )
,下列叙述中错误的是( )
A. A属于醛类,其相对分子质量为58,1 mol A与足量的银氨溶液反应可生成4 mol Ag
B. B在一定条件下可通过缩聚反应得到一种新的高聚物
C. 高分子化合物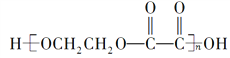 的组成与B、C等物质的混合物的组成相同
的组成与B、C等物质的混合物的组成相同
D. B、C生成高聚物的反应为缩聚反应
查看答案和解析>>
科目: 来源: 题型:
【题目】a、b、c、d、e、f为元素周期表前四周期元素,且原子序数依次增大。a原子核内无中子;在考古行业中,元素b的一种核素常用来鉴定一些文物的年代;d原子核外电子有8种不同的运动状态;e为第四周期元素,其基态原子的价电子排布式中成对电子的电子对数与单电子数相等,且每个原子轨道中都有电子;f元素的基态原子最外能层只有1个电子,且其他能层均已充满电子。回答下列问题:
(1)六种元素中电负性最大的是__(填元素符号),其中e原子的价电子排布式为__。
(2)b有多种同素异形体,其中硬度最大的是___(填名称);写出一种属于分子晶体的b的同素异形体的化学式__。
(3)a、c形成的简单分子的化学式为___,分子中c原子的杂化类型为__,分子立体构型为___。
(4)六种元素中其中有两种元素形成的化合物___(填化学式)与c的单质互为等电子体。
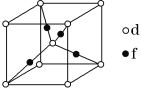
(5)元素d与f形成的一种化合物的晶胞结构如图所示,其中黑球在两个白球连线的中点。该化合物的化学式为__;若相邻d原子和f原子间的距离为acm,阿伏加德罗常数的值为NA,则该晶体的密度为__g·cm-3(用含a、NA的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:__。
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=___。
②在该温度下反应的平衡常数K=___。
③关于上述反应,下列叙述正确的是___(填字母)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:

若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ___(不要求标出CO的终点坐标)。
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:

请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
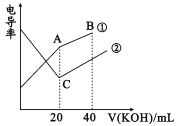
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目: 来源: 题型:
【题目】分别以下列各组物质作为单体在一定条件下,通过缩聚反应能合成高分子化合物的是( )
①乙烯、丙烯、苯乙烯
②乙酸、乙二醇
③1,![]() 己二酸、1,
己二酸、1,![]() 己二胺
己二胺
④对苯二甲酸、乙二醇
⑤α-氨基乙酸、α-氨基丙酸
⑥α-羟基丙酸
A.①③⑤⑥B.①②③④C.③④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】现有 A、B、C、D、E、F、G、H 八种元素,均为前四周期元素,它们的原子序数依次增大。 请根据下列相关信息,回答有关问题。
A 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素
B 元素是形成化合物种类最多的元素
C 元素基态原子的核外 p 电子数比 s 电子数少 1
D 元素基态原子的核外 p 轨道中有两个未成对电子
E 元素的气态基态原子的第一至第四电离能分别是 I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F 元素的主族序数与周期数的差为 4
G 元素是前四周期中电负性最小的元素
H 元素位于元素周期表中的第八纵行
(1)C2A4 的电子式为__________ (A、C 为字母代号,请将字母代号用元素符号表示,下同)。
(2)B 元素的原子核外共有__________种不同运动状态的电子。
(3)某同学推断 E 元素基态原子的核外电子排布图为 ![]() 。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是____________________。
。该同学所画的电子排布图违背了_________,该元素原子的 I3 远远大于 I2,其原因是____________________。
(4)D、E、F 三种元素的简单离子半径由大到小的顺序是__________ (用离子符号表示)。
(5)用惰性电极电解 EF2 的水溶液的离子方程式为__________。
(6)H 位于元素周期表中__________区(按电子排布分区),其基态原子的价电子排布式为_________,实验室用一种黄色溶液检验 H2+时产生蓝色沉淀,该反应的离子方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M的结构简式如图所示,与氢气发生加成反应得到物质甲,下列有关说法错误的是( )
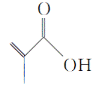
A.有机物M含有2种官能团
B.有机物M的分子式为C4H6O2
C.有机物M能发生取代反应、加聚反应
D.甲的只含有一种官能团的链状同分异构体有6种
查看答案和解析>>
科目: 来源: 题型:
【题目】以赤铁矿(主要成分为60.0%Fe2O3,杂质为3.6%FeO,Al2O3,MnO2,CuO等)为原料制备高活性铁单质的主要生产流程如图所示:

已知部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Cu(OH)2 |
pH | 3.4 | 5.2 | 9.7 | 6.7 |
请回答下列问题:
(1)含杂质的赤铁矿使用前要将其粉碎,目的是___。操作Ⅰ的名称是___。
(2)将操作Ⅰ后所得的MnO2与KClO3、KOH溶液混合共热,可得到K2MnO4,此反应的化学方程式是____。
(3)将pH控制在3.6的目的是___。已知25℃时,Ksp[Cu(OH)2]=2×10-20,该温度下反应Cu2++2H2O![]() Cu(OH)2+2H+的平衡常数K=___。
Cu(OH)2+2H+的平衡常数K=___。
(4)加入双氧水时反应的离子方程式为___。
(5)利用氨气在500℃以上分解得到的氮原子渗透到铁粉中可制备氮化铁(FexNy),若消耗氨气17.0g,消耗赤铁矿石1kg,写出该反应完整的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com