
科目: 来源: 题型:
【题目】海洋是一个资源宝库,海水资源的开发和利用是现代和未来永恒的主题。下面是海水利用的流程图:
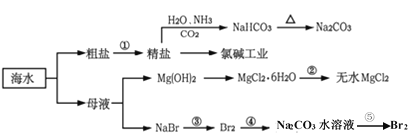
下列有关说法不正确的是
A.过程中制得NaHCO3是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生了使湿润淀粉碘化钾试纸变蓝的气体
C.反应②加热MgCl2·6H2O应在HCl气流保护下制备无水MgCl2
D.反应⑤中,用Na2CO3水溶液吸收Br2后,用70—80%硫酸富集Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种元素原子序数依次增大,前四种为短周期元素,E、F位于第四周期。已知A是自然界中含量最多的元素;B、C、D同周期,且B在同周期元素中第一电离能最小;C的第一、二、三电离能分别为738 kJ·mol1、1451 kJ·mol1、7733 kJ·mol1;D在同周期元素中(除稀有气体元素外)第一电离能最大;E元素为金属元素,常用于合成催化剂,其基态原子的价电子数为7;F元素的某种高价盐可用作城市饮用水的净水剂,比D的单质用于净水更安全环保,F基态原子的3d能级上有6个电子。
(1)试写出下列四种元素的元素符号:A_____;B_____;E_____;F_________。
(2)写出A、B两种元素组成的所有化合物的化学式:_____________。
(3)写出电解CD2的化学方程式:_____。
(4)E、F均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | E | F | |
电离能/ kJ·mol1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
E元素位于第ⅦB族,请画出基态E2+的价电子排布图:_____,F元素在周期表中的位置是_____。比较两元素的I2、I3可知,气态基态E2+再失去1个电子比气态基态F2+再失去1个电子更难,对此你的解释是:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为长式周期表的一部分其中的编号代表对应的元素.
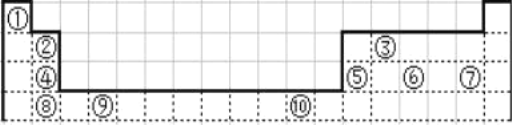
请回答下列问题:
(1)表中属于 ds 区的元素是_____(填元素符号)它的基态原子的价电子排布式为_____。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为________,其中元素③的原子的杂化类型为_____;①和⑥形成的一种常见四原子分子的化学式为______,其立体构型为_________。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为_____;该元素与元素①形成的最简单分子 X 的电子式为_____。
(4)元素⑤的电负性_____④元素的电负性(选填>、=、<下同);元素⑥的第一电离能_____原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程_____。
(6)上表中元素⑤的氢氧化物为两性氢氧化物,请写出元素⑤的氢氧化物与NaOH溶液反应的化学方程式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
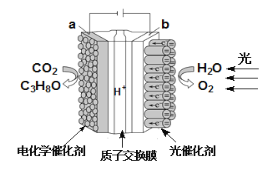
A.该装置工作时,H+从a极区向b极区迁移
B.该装置将化学能转化为光能和电能
C.a电极的反应式为3CO2+18H+-18e-=C3H8O+5H2O
D.每生成3 mol O2,有88 g CO2被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】向某恒容密闭容器中加入1.6 mol L-1的NO2后,会发生如下反应:2NO2(g)N2O4(g) △H =-56.9kJmol-1。其中N2O4的物质的量浓度随时间的变化如图所示,下列说法不正确的是
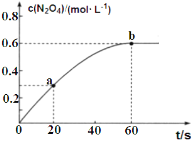
A.升高温度,60s后容器中混合气体颜色加深
B.0-60s内,NO2的转化率为75%
C.0-60s内,v(NO2)=0.02mol L-1 s-1
D.a、b两时刻生成NO2的速率v(a)>v(b)
查看答案和解析>>
科目: 来源: 题型:
【题目】原子晶体是由原子直接通过共价键形成的空间网状结构的晶体,又称共价晶体,因其具有高熔沸点、硬度大、耐磨等优良特性而具有广泛的用途。
(1)晶体硅是良好的半导体材料,被广泛用于信息技术和能源科学等领域。晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体的1个晶胞中含_____个Si原子,在晶体硅的空间网状结构中最小环为_____元环,每最小环独立含有__________个Si原子,含1molSi原子的晶体硅中Si-Si键的数目为_____。
(2)金刚砂(SiC)也与金刚石具有相似的晶体结构(如图丙所示),在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。试回答下列问题:
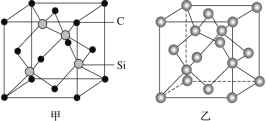
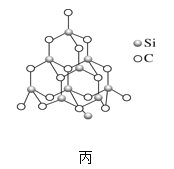
①金刚砂、金刚石、晶体硅的熔点由低到高的顺序是_____(均用化学式表示)。
②在金刚砂的结构中,一个碳原子周围结合了_____硅个原子,其键角是_____。
③金刚砂的结构中含有C、Si原子以共价键结合形成的环,其中一个最小的环上独立含有_个C-Si键
④金刚砂的晶胞结构如图甲所示,在SiC中,每个C原子周围最近等距的C原子数目为_____;若金刚砂的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中最近的两个碳硅原子之间的距离为_________pm(用代数式表示即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中各组物质之间不能通过一步反应实现如图转化的是

甲 | 乙 | 丙 | |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | NH3 | NO | HNO3 |
C | AlCl3 | Al(OH)3 | Al2O3 |
D | Cl2 | HCl | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年2月,国家卫生健康委办公厅、国家中医药管理局办公室联合发出《关于印发新型冠状病毒肺炎诊疗方案(试行第六版)的通知》。此次诊疗方案抗病毒治疗中增加了阿比多尔这个药物。其中间体I的合成路线如下:

(1)A的结构简式是 _____。
(2)I中含氧官能团名称是_____。
(3)③、⑦的反应类型分别是 _____________、 __________ 。
(4)②的化学方程式为_________________________。
(5)D的同分异构体中,满足下列条件的有_______种。
a. 含有苯环 b.含有-NO2
其中核磁共振氢谱为3组峰,且峰面积之比为1∶2∶6的为____________(任写一种结构简式)。
(6)已知:①当苯环有RCOO-、烃基时,新导入的基团进入原有基团的邻位或对位;原有基团为-COOH时,新导入的基团进入原有基团的间位。②苯酚、苯胺(![]() )易氧化。设计以
)易氧化。设计以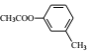 为原料制备
为原料制备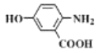 的合成路线(无机试剂任用)__________________。
的合成路线(无机试剂任用)__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)铜原子有 _____种不同运动状态的电子,亚铜离子的价电子排布式为:_____。
(2)铜能与类卤素(CN)2 反应生成 Cu(CN)2,1 mol (CN)2 分子中含有π键的数目为____,C、N 两元素可形成的离子 CN-,该离子的结构式为_____,请写出 CN-的一种等电子体_____(写化学式)。
(3)CuCl2 溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2 ]2+(En 是乙二胺的简写),结构如图所示
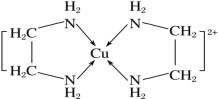
已知配合物的中心粒子的配位数指配位原子总数,则 Cu2+的配位数为_________, 该配离子中所含的非金属元素的电负性由小到大的顺序是_____;乙二胺分子中氮原子轨道的杂化类型为____,乙二胺(En)和三甲胺 [N(CH3)3 ]均属于胺类,相对分子质量相近,但乙二胺的沸点却比三甲胺的沸点高得多,其原因是:_____。
(4)某 M 原子的外围电子排布式为 3s23p5,铜与 M 形成化合物的晶胞如图所示
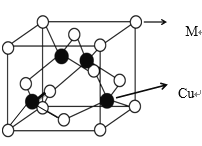
①已知铜和 M 的电负性分别为 1.9 和 3.0,则铜与 M 形成的该种化合物属于__________(填“离子”或“共价”)化合物,其化学式为__________。
②铜和形成的晶体中每个 M 原子周围最近等距的铜原子数目为_____。
③已知该晶体的晶胞参数(即立方体晶胞的棱长)为 acm,则该晶体中两个相距最近的 M 原子之间的核间距为_____pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com