
2008――2009学年度
高二上学期期末复习系列专题一――计算专题
本学期学习的一~四章内容均涉及到计算,为方便同学们复习,现总结如下:
 ①利用电子守恒计算
①利用电子守恒计算
②利用电荷守恒计算
 1、有关硝酸 ③利用元素(原子)守恒计算
1、有关硝酸 ③利用元素(原子)守恒计算
的计算 ④利用3Cu +8H++2NO3―==3Cu2++2NO+4H2O
 ①根据3NO2 +H2O==2HNO3+NO进行计算
①根据3NO2 +H2O==2HNO3+NO进行计算
2、有关NOx与O2混 ②根据4NO2 + O2+2H2O==4HNO3进行计算
合后溶于水的计算 ③根据4NO + 3O2+2H2O==4HNO3进行计算
第一章:氮族 ④计算HNO3的物质的量浓度
元素
3、有关过量的计算 (先判断过量,再根据少量的计算)
 ①明确已知和未知
①明确已知和未知
4、有关多步反应的计算 ②明确化学过程
 ③建立关系式列比例式求算
③建立关系式列比例式求算
1、有关化学反应速率的计算
第二章:化学反应速率 2、有关化学平衡简单计算
化学平衡 3、快速计算


 单一溶液的计算 强酸与强酸
单一溶液的计算 强酸与强酸
1、溶液的pH计算 混合溶液的计算 强碱与强碱
第三章:电离平衡 强酸与强碱
2、有关酸碱中和滴定的计算(谁滴谁?多滴还是少滴?)
 1、图像计算题(注意横、纵坐标的含义,每个重要的点的含义,每一段所发生的化学反应)
1、图像计算题(注意横、纵坐标的含义,每个重要的点的含义,每一段所发生的化学反应)
第四章:几种重要的金属 2、有关铁和铁的化合物的计算
见《几种重要的金属 3、有关原电池的简单计算
计算题巧解例谈》
例题分析:
第一章:氮族元素
1、某单质与浓HNO3反应时,还原产物为NO2,每有1 mol单质参加反应就消耗4 mol HNO3,则该单质被氧化后元素的化合价可能是 ( )
A +1 B +
2、某金属单质与一定浓度的硝酸反应,假定只生成单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2∶1,则还原产物为( )
A NO2 B NO C N2O D N2
3、
A、504mL B、168mL C、336mL D、224mL
4、将Mg、Cu组成的
 [解析]:Mg2+、Cu2+完全沉淀生成Mg(OH)2、Cu(OH)2时结合OH-的物质的量,即为Mg、Cu失去电子的物质的量,所以沉淀质量为,答案为B项。
[解析]:Mg2+、Cu2+完全沉淀生成Mg(OH)2、Cu(OH)2时结合OH-的物质的量,即为Mg、Cu失去电子的物质的量,所以沉淀质量为,答案为B项。
5、38.4mg铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4mL(标准状况),反应消耗硝酸的物质的量可能是()
[解析]:由Cu元素守恒,0.6×10-3mol Cu可生成0.6×10-3mol Cu(NO3)2,需1.2×10-3mol HNO3,由N元素守恒,生成1×10-3mol的NOx气体,需1×10-3mol HNO3,因此,反应共消耗硝酸2.2×10-3mol。答案为C项。
6、某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入
A 0.15mol/L B 0.3mol/L C 0.225mol/L D 无法计算
7、NO与NO2的混合气体60ml,通入水中,最后收集到的气体体积为40ml(气体体积均在相同条件下测定),则原混合气体中NO与NO2的体积比为 ( )
(A) 1∶2 (B) 2∶3 (C) 3∶2 (D)1∶1
8、在标准状况下,将NO2、NO、O2混合后充满容器,倒置于水中,完全溶解,无气体剩余,若产物也不扩散,则所得溶液物质的量浓度的数值范围是( )
A.0<c<1/22.4 B.1/39.2<c<1/
20、甲、乙两烧杯中分别盛有50mL等物质的量浓度的稀硫酸,向甲烧杯中加入m克Fe,
第二章:化学反应速率 化学平衡
9、在一个 2Q(气)+nR(气)。达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应式中n值是:
2Q(气)+nR(气)。达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应式中n值是:
A. 3
B.
10、某容积可变的密闭容器中放入一定量的A和B的混合气体,在一定条件下发生反应:A(气)+2B(气)
A.原混合气体的体积为1.1V B. 原混合气体体积为1.2V
C.原混合气体的体积为1.3V D.原混合气体体积为1.4V
11、用0.1mol?L-1 NaOH溶液滴定0.1mol?L-1盐酸,如达到滴定终点时不慎多滴了1
滴NaOH溶液(约为0.05mL),继续加水至50mL,所得溶液pH是( )
A. 4 B.
12、pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相等的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A. 9
B.
【解析】:设每份盐酸的体积是 ,
, 。故二者比值为11。
。故二者比值为11。
几种重要的金属计算题巧解例谈
一、终态法
例1.有镁、铝的混合粉末10.2g,将它溶于500mL,4mol?L?1的盐酸中,若要得到沉淀量为最大值,则需加入2mol?L?1的NaOH溶液的体积为 ( )
A.300mL B.500mL C.1000mL D.1500mL
[解析]:有关反应为:Mg+2HCl = MgCl2+H2↑ 2Al+6HCl = 2AlCl3+3H2↑
HCl+NaOH=NaCl +H2O(可能) MgCl2+2NaOH =Mg(OH)2↓ +2NaCl
AlCl3+3NaOH = Al(OH)3↓+3NaCl
若要由反应方程式分别求出镁、铝的物质的量,繁而难解,可运用“终态法”,沉淀为最大量时,即镁、铝全部以=Mg(OH)2 、Al(OH)3存在,而此时溶液中只存在NaCl,则根据原子守恒,有:n(NaOH)=n(HCl)=0.5L×4mol?L?1=2mol,V(NaOH)=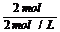 =1L=1000mL,选C。
=1L=1000mL,选C。
二、等量代换法
例2.有一块Al-Fe合金,溶于足量的盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧完全变成红色粉末后,经称量,红色粉末的质量恰好与合金的质量相等,则合金中铝的质量分数为 ( )
A.70% B.30% C.47.6% D.52.4%
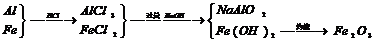 [解析]: 变化主要过程为:
[解析]: 变化主要过程为:
由题意得:Fe2O3与合金的质量相等,而铁全部转化为Fe2O3,故合金中Al的质量即为Fe2O3中氧元素的质量,则可得合金中铝的质量分数即为Fe2O3中氧的质量分数,O%=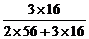 ×100%=30%,选B。
×100%=30%,选B。
三、电荷守恒法
例3.将8gFe2O3投入150mL某浓度的稀硫酸中,再投入7g铁粉收集到1.68LH2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol/L的NaOH溶液150mL。则原硫酸的物质的量浓度为
[练习]:将mgAl2O3、Fe2O3的混合物溶解在过量的100ml0.05mol/LH2SO4溶液中,向其中加入NaOH溶液,使Fe3+、Al3+刚好全部转化为沉淀,用去NaOH溶液100ml,NaOH溶液的物质的量浓度是 mol/L。
[解析]:当Fe3+、Al3+刚好全部转化为沉淀时,溶液为Na2SO4,该溶液显中性,所以n(Na+)=2n(SO42-)=2n(H2SO4)=0.01mol,即 n(NaOH)=0.01mol。所以c(NaOH)=0.1mol/L
四、得失电子守恒法
例4.某稀硝酸溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,生成NO,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为 ( )
A.4∶1 B.2∶
[解析]:设Fe2+为xmol,Fe3+为ymol,则:
x+y=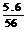 =0.1(Fe元素守恒)
=0.1(Fe元素守恒)
2x+3y=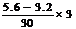 (得失电子守恒)得:x=0.06mol,y=0.04mol。则x∶y=3∶2。故选D。
(得失电子守恒)得:x=0.06mol,y=0.04mol。则x∶y=3∶2。故选D。
五、元素守恒
例5.将几种铁的氧化物的混合物加入100mL、7mol•L?1的盐酸中。氧化物恰好完全溶解,在所得的溶液中通入0.56L(标况)氯气时,恰好使溶液中的Fe2+完全转化为Fe3+,则该混合物中铁元素的质量分数为 ( )
A.72.4% B.71.4% C.79.0% D.63.6%
[解析]:铁的氧化物中含Fe和O两种元素,由题意,反应后,HCl中的H全在水中,O元素全部转化为水中的O,由关系式:2HCl~ H2O ~O,得:n(O)=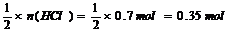 ,m(O)=0.35mol×
,m(O)=0.35mol×
而铁最终全部转化为FeCl3,n(Cl)=0.56L ÷22.4L/mol×2+0.7mol=0.75mol,n(Fe)=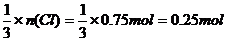 ,m(Fe)=0.25mol×56g•mol?1=14 g,则
,m(Fe)=0.25mol×56g•mol?1=14 g,则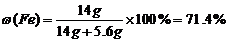 ,故选B。
,故选B。
六、关系式法
例6. 16g硫粉和42 g铁粉,混合并在隔绝空气情况下加热,当完全反应后,再加入过量的盐酸,生成的气体在标准状况下的体积为 ( )
[解析]:在铁与硫的反应后,无论何种物过量,与最终的气体量无关。因为:
Fe ~ H2↑ ,FeS ~ H2S↑;即气体的物质的量等于铁的物质的量。n(Fe)=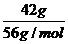 =0.75mol,v(↑)= 0.75mol×
=0.75mol,v(↑)= 0.75mol×
七、摩尔电子质量法
例7.由两种金属组成的合金10g投入足量的稀硫酸中,反应完全后得到氢气11.2L(标准状况下),此合金可能是 ( )
A.镁铝合金 B.镁铁合金 C.铝铁合金 D.镁锌合金
[解析]:将金属每失去1mol电子所需金属的质量称为摩尔电子质量。由题意,生成0.5molH2,金属失去的电子即为1mol,即合金的平均摩尔电子质量为
八、极端假设法
例8.含n g硝酸的稀溶液恰好和m g铁粉充分反应,铁与硝酸均无剩余,若硝酸还原产物只有NO,n∶m不可能是 ( )
A. 2∶1 B. 4∶
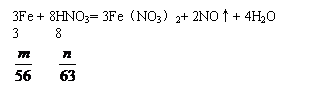 |
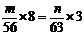 ,
,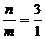 ;
;
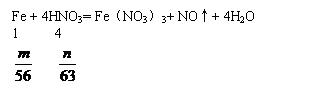 |
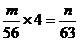
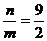 则
则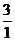 ≤
≤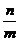 ≤
≤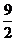 ,故选A。
,故选A。
综合练习
1、取一定量的Fe、Cu的混合物粉末,平均分成五等份,分别向每一份中加入一定量的稀硝酸,实验中收集到的NO气体(唯一还原产物)的体积及所得剩余物的质量记录如下(所有体积均在标准状况下测定):
实验序号
1
2
3
4
5
硝酸溶液体积
100mL
200 mL
300 mL
400 mL
500 mL
剩余固体的质量
气体体积
⑴该实验中所用硝酸的物质的量浓度为________________。
⑵第1次实验后剩余固体为_________,第2次实验后剩余固体为______。(均填写化学式)。
⑶求实验中每次所取混合物中铜的质量。
[解析]:⑴c(HNO3)=4mol/L
由第一组数据可知固体有剩余。无论硝酸和什么金属反应,都有n(HNO3)=4 n(NO)。加入100 mL硝酸溶液时,n(NO)=0.1mol,则n(HNO3)=0.4mol,c(HNO3)=4mol/L。
⑵Fe、Cu Cu
由1、2两组数据分析,两次剩余物的质量相差9.2g,此时生成2.24 LNO气体(转移0.15 mol电子)。若只溶解铁,质量为8.4 g,若只溶解铜,质量为9.6 g。由此可知这
9.2 g中应有Fe和Cu两种金属。
所以第一次实验后剩余金属为Fe和Cu。第二次实验后剩余金属只有Cu。
⑶由以上分析可知,第二次实验后剩余铜
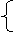 56 x+64 y=9.2 ⑴
56 x+64 y=9.2 ⑴
2(x+y)=3×0.1 ⑵ 解得y=0.1 mol,质量是
每次所取混合物中铜的质量6.4 g+8 g=14.4 g。
2、有
A FeO B Fe2O
[解析]:由题意得知,铁的氧化物中的氧原子最后转移到沉淀物CaCO3中。且n(O)=n(CaCO3)=0.0075mol,
m(O)=0.0075mol×
m(Fe)=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com