
科目:gzhx 来源: 题型:058
在4mol/L的氢氧化钠溶液中加入20mL 2mol/L的氯化铝溶液,振荡后无沉淀.若再滴入2mol/L的盐酸,当滴至20mL时开始产生沉淀.
(1)求原来氢氧化钠溶液的体积.
(2)若再滴加2mol/L的盐酸使产生的沉淀刚好消失,需加多少毫升?
科目:gzhx 来源: 题型:
在4mol/L的NaOH溶液中加入20mL2mol/LA1C13溶液,振荡后无沉淀,若再滴入2mol/L的盐酸,当滴至20mL时开始产生沉淀。
(1)求原来的NaOH溶液的体积
(2)若再滴加2mol/L的盐酸直至使产生的沉淀刚好消失,需加多少毫升?
科目:gzhx 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:038
在4 mol/L的氢氧化钠溶液中加入20 mL 2 mol/L的氯化铝溶液,振荡后无沉淀.若再滴入2 mol/L盐酸,当滴至20 mL时开始产生沉淀.
(1)求原来氢氧化钠溶液的体积.
(2)若再滴加2 mol/L的盐酸使产生的沉淀刚好消失,需加多少毫升?
科目:gzhx 来源:物理教研室 题型:038
(1)求原来氢氧化钠溶液的体积。
(2)若再滴加2mol×L-1的盐酸使产生的沉淀刚好消失,需加多少毫升?
科目:gzhx 来源: 题型:038
在4mol×L-1的氢氧化钠溶液中加入20mL2mol×L-1的氯化铝溶液,振荡后无沉淀。若再滴入2mol×L-1盐酸,当滴至20mL时开始产生沉淀。
(1)求原来氢氧化钠溶液的体积。
(2)若再滴加2mol×L-1的盐酸使产生的沉淀刚好消失,需加多少毫升?
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | --- |
科目:gzhx 来源: 题型:
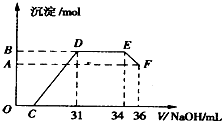
 (2012•上海模拟)某同学取一定量的Al和Fe固体混合物,与2.0L极稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(2012•上海模拟)某同学取一定量的Al和Fe固体混合物,与2.0L极稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:科目:gzhx 来源: 题型:
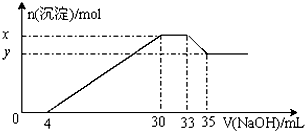
| A、原溶液中n(Mg2+):n(Al3+)=10:1 | B、原溶液中的c(H+)=0.8mol/L | C、x与y的差值为0.01mol | D、原溶液中c(Cl-)=0.66mol/L |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
某同学取一定量的Al和Fe固体混合物,与2.0 L极稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
1、图中OC段没有沉淀生成,此阶段发生反应的离子方程式为 。
在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
;上述现象说明溶液中______________结合OH-的能力比___________强(填写离子符号)。
2、B与A的差值为______________mol。
3、B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为______________mL。
4、求原硝酸溶液的物质的量浓度?
科目:gzhx 来源: 题型:阅读理解
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | --- |
I.(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金. 理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理: ( 填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,下列试剂中最好的是 (填序号),并说明理由:_____________________________________________________.
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
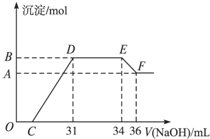
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度 越稀,对应还原产物中氮元素的化合价越低。为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
越稀,对应还原产物中氮元素的化合价越低。为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1)逐滴加入4mol/L的氢氧化钠溶液的定量玻璃仪器 图中OC段没有沉淀生成的原因是:__________________________.(用离子方程式表示)
(2)由上述图形分析可知,溶液中结合OH-能力最强的离子是_______(填离子符号,下同)、最弱的离子是 。若测定F点沉淀的质量,需对混合物进行:过滤、 、 、称量。
(3)通过上图数据试计算,熔融物中两种金属的物质的量之比n(Fe):n(Al)= 。
科目:gzhx 来源:2012-2013学年山东省枣庄三中高三(上)期末化学试卷(解析版) 题型:解答题
科目:gzhx 来源: 题型:解答题
 某同学取一定量的Al和Fe固体混合物,与2.0L极稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
某同学取一定量的Al和Fe固体混合物,与2.0L极稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:科目:gzhx 来源: 题型:
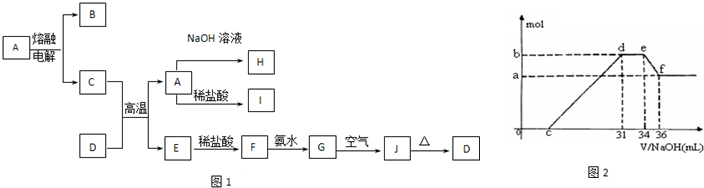
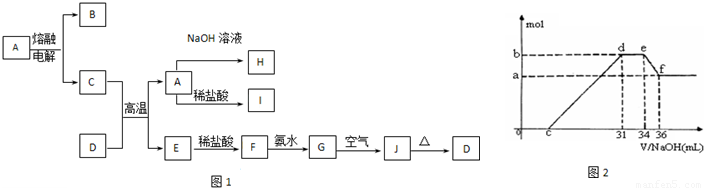
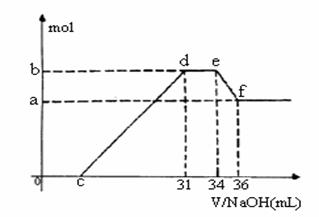
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。请回答下列问题:
 |
(1) A的化学式为
(2) H溶液中通入过量的CO2,其反应的离子方程式是
G→J的化学方程式为
(3) D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因
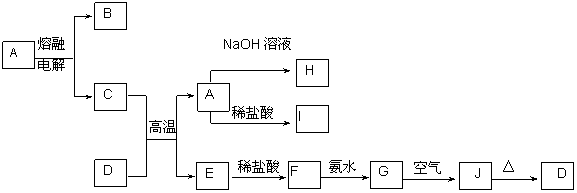
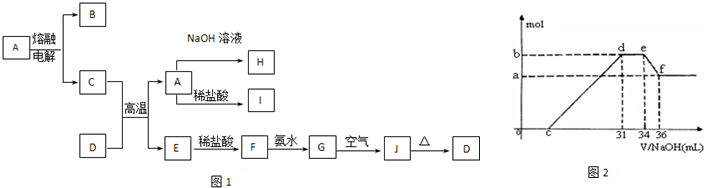
(4) 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的C、E混合物 与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
① 图中o c段没有沉淀生成,此阶段发生反应的离子方程式为__________________________。
② 在d e段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式_______________ ;
上述现象说明溶液中_______结合OHˉ的能力最强(填离子符号)。
③ b与a的差值为_________mol。
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:解答题
科目:gzhx 来源: 题型:
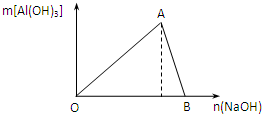 如图为100mL2mol/L的AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
如图为100mL2mol/L的AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:科目:gzhx 来源: 题型:
| 序号 | 操 作 | 现 象 | 结 论 |
| ① | 在第一份溶液中取少量放入试管中,滴加几滴酚酞溶液. | 溶液变红 | 溶液中一定有氢氧化钠 |
| ② | 将第二份溶液放入试管中,加入足量澄清石灰水. | 生成白色沉淀 | 溶液中一定有碳酸钠 |
| ③ | 将②所得溶液过滤,将固体洗涤、干燥、称重 | 沉淀质量5克 | 原来通入的CO2气体体积在标况下为2.24L |
| 序号 | 结论是否正确 | 理 由 |
| ① | 不正确 不正确 |
因为碳酸钠或碳酸氢钠水解,溶液显碱性,也能使酚酞变红 因为碳酸钠或碳酸氢钠水解,溶液显碱性,也能使酚酞变红 |
| ② | 不正确 不正确 |
因为碳酸氢钠也能与石灰水反应生成沉淀,可能是碳酸氢钠 因为碳酸氢钠也能与石灰水反应生成沉淀,可能是碳酸氢钠 |
| ③ | 正确 正确 |
碳酸钙质量5g,根据C原子守恒,二氧化碳为0.05mol,标况下为1.12L 碳酸钙质量5g,根据C原子守恒,二氧化碳为0.05mol,标况下为1.12L |
科目:gzhx 来源: 题型:
| a |
| 60 |
| a |
| 60 |