
科目:czsx 来源: 题型:
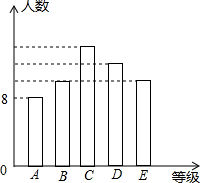
 某中学九年级在中考模拟考试后,随机抽取若干名学生的数学成绩分成A,B,C,D,E五个等级,并作出了如图所示的统计图.已知图中各等级长方形的高度从左到右的比分别是4:5:7:6:5,其中A等级的人数为8人,则:
某中学九年级在中考模拟考试后,随机抽取若干名学生的数学成绩分成A,B,C,D,E五个等级,并作出了如图所示的统计图.已知图中各等级长方形的高度从左到右的比分别是4:5:7:6:5,其中A等级的人数为8人,则:| 7 |
| 27 |
| 7 |
| 27 |
科目:gzls 来源: 题型:阅读理解
(2013·三明模拟)阅读下列材料,回答问题。
材料一 历史学家黄仁宇认为:中国在历史上产生过九个统一全国的大朝代,我们可称秦汉为“第一帝国”,隋唐宋为“第二帝国”,明清则为“第三帝国”。第一帝国的政体还带贵族性格,世族力量强大。第二帝国则大规模和有系统地科举取士,造成新的官僚政治,而且将经济重心由华北的旱田地带逐渐转移到华南的水田地带……若将第二帝国和第三帝国比较,则可以看出第二帝国“外向”“开放”,带“竞争性”。与明清之“内向”“保守”及“非竞争性”迥然不同……第二帝国带扩张性,而第三帝国则带收敛性。
(1)根据材料一及所学知识,概括指出“第二帝国”在政治结构和选官制度方面与“第一帝国”相比发生了哪些主要变化。(4分)结合有关史实,说明第三帝国的“内向”“保守”及“非竞争性”主要表现在哪些方面。(2分)
材料二 从18世纪70-80年代起,一直到19世纪30年代……英国出现了这样一幅奇特的景象:保守主义的政治与快速发展的经济同行。
材料三 1796年时,120名下院议员是贵族或贵族子孙,占下院总人数的21%,还有数百人与贵族有亲戚关系,或者是在贵族的帮助下当选的,二者加在一起,超过全院人数的70%。
——程汉大《文化传统与政治变革》
(2)材料二中“保守主义的政治”是如何建立的?(1分)依据材料三,结合所学知识,概括该时期保守主义政治的特征。(3分)
材料四 “辉煌属于希腊”,古雅典为近代民主的发展和完善提供了许多有益的借鉴。美国历史学家J·布卢姆说:“1787年在费城所起草的宪法是试验时期最伟大的创造性胜利……全世界都说,像美国规模这么大的国家,要建立共和制度是不可能的。但是这里却兴起了一个新型的共和国,一个虽然疆域和人口扩大十倍,但依然对人民负责的政府……”
——《美国的历程》
(3)依据材料四并结合所学知识,回答美国是怎样突破古代民主的局限,又是怎样维护民主的。(4分)
材料五 目前中国正在进行当代最伟大的社会实践……中国定将实现一种特殊的民主,这种民主将考虑到这个大国的社会、文化和经济特点,这种民主所涉及的是史无前例地继续思考“孔子的公共伦理”,而不是抽象地复制西方资产阶级民主。
——2008年2月7日德国《新德意志报》
(4)材料五所说的“特殊的民主”在社会主义现代化建设的新时期是通过哪些政治制度来实现的?(4分)综合上述材料,谈谈你对民主政治发展的认识。(2分)
科目:czsx 来源: 题型:解答题
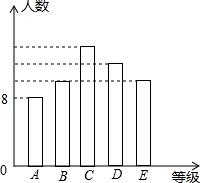 某中学九年级在中考模拟考试后,随机抽取若干名学生的数学成绩分成A,B,C,D,E五个等级,并作出了如图所示的统计图.已知图中各等级长方形的高度从左到右的比分别是4:5:7:6:5,其中A等级的人数为8人,则:
某中学九年级在中考模拟考试后,随机抽取若干名学生的数学成绩分成A,B,C,D,E五个等级,并作出了如图所示的统计图.已知图中各等级长方形的高度从左到右的比分别是4:5:7:6:5,其中A等级的人数为8人,则:科目:czsx 来源:不详 题型:解答题
科目:gzsx 来源:2016届湖南省长沙市高三上学期月考五文科数学试卷(解析版) 题型:解答题
近两年来,各大电视台都推出了由明星参与的游戏竞技类节目。高一某研究性学习小组在长沙某社区对50人进行第一时间收看该类节目与性别是否有关的收视调查,其中20名女性中有15名第一时间收看该类节目,30名男性中10名第一时间收看该类节目.
(1)根据以上数据建立一个 列联表,并判断第一时间收看该类节目是否与性别有关?
列联表,并判断第一时间收看该类节目是否与性别有关?
(2)该研究性学习小组共有A、B、C、D和E五名同学,五人分成两组模拟“撕名牌”的游戏,其中一组三人,一组两人,求A、B两同学分在同一组的概率.
参考数据: .
.
临界值表:
| 0.100 | 0.050 | 0.025 | 0.010 | 0.005 | 0.001 |
k | 2.706 | 3.841 | 5.024 | 6.635 | 7.879 | 10.828 |
科目:gzsx 来源: 题型:解答题
| P(X2≥k) | 0.100 | 0.050 | 0.025 | 0.010 | 0.005 | 0.001 |
| k | 2.706 | 3.841 | 5.024 | 6.635 | 7.879 | 10.828 |
科目:gzsx 来源: 题型:解答题
| P(Χ2≥k) | 0.100 | 0.050 | 0.025 | 0.010 | 0.005 | 0.001 |
| k | 2.706 | 3.841 | 5.024 | 6.635 | 7.879 | 10.828 |
科目:gzdl 来源:地理教研室 题型:069
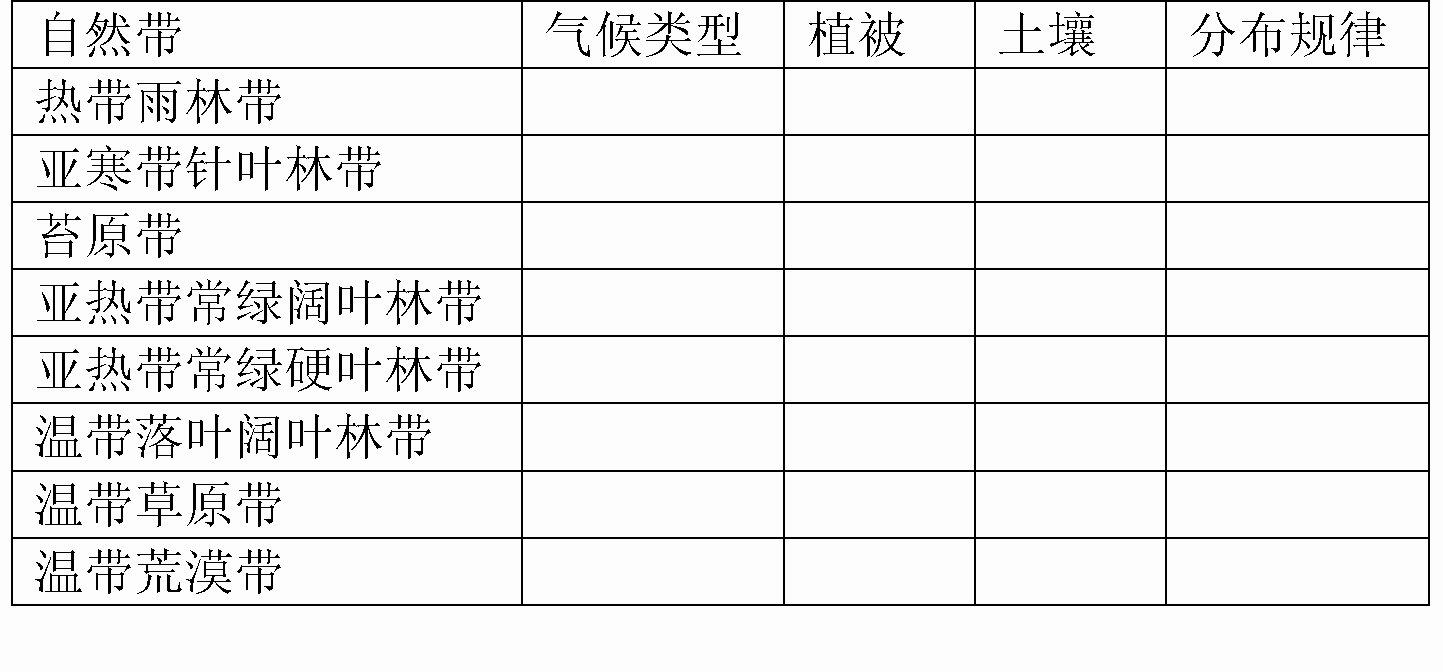
祝贺你和你的同学已被选为环球考察队成员。你们的任务是研究地球上地理环境的差异性,你要收集这些地区的气候、植被、河流、土壤等要素的资料与数据。你们这次考察的成果将被用作创建一个地理环境的信息数据库。指导你们考察的科学家已经着重选择了六个地区。你的行程将从寒风凛冽的北极苔原到水气蒙蒙的热带雨林。出发前务必整理好你的行装。
环球考察的第一站是赤道附近的热带雨林。这里不但炎热且潮湿,时常出现倾盆大雨,一阵阵雨过后,太阳又出来了。尽管阳光灿烂,但浓密的植被层的阳光还是很少的。
(1)从考察中你可以了解到地理环境各要素并不是彼此孤立的,而是作为一个整体存在的。请你把对这里河流的考察报告写出来,并分析形成本自然带的主导因素是什么?
考察的第二站是50°~70°N附近的亚寒带针叶林。这里最热月平均气温高于10℃,生长着大量的松、云杉、冷杉等耐寒的针叶树种,是森林资源宝库。
当到达考察的第三站时,这里的季节正是秋天,刀割一般的冷风使你们直接感受到苔原的气候特点。自然植被以苔藓、地衣为主,所以称为寒带苔原带。苔原地带的许多土地都是终年冰冻着。夏季每天光照时间是最长的,仲夏的太阳是不落的。这里的动物有驯鹿、北极狐等。
考察的第四站是沙漠,这里的年降水量少于250毫米,水的蒸发量远大于降水量,一天的温差通常很大。生活在沙漠中的生物既要适应缺水状况,又要适应温差大的恶劣条件,许多动物都是在晚上出来活动的。
考察的第五站是草原,这里的气温要比在沙漠里舒服许多,年降水量在250~270毫米之间,这片肥沃的土地上长满了牧草。
考察的第六站将带你到另一片森林——落叶阔叶林,这里冬天的气温在0℃以下,夏季早晨凉爽,白天仍很炎热,这里的树木每年树叶都会掉落。
(2)请你比较分析一下第六站处的森林与前面考察的热带雨林有何不同?并分析形成森林到沙漠自然带的主导因素是什么。
(3)指导你们考察的科学家要求你们写一篇考察报告,内容包括:分析是什么原因导致了这些地区地理环境差异的产生;以上考察的这些地区在分布上有什么规律可循。
(4)根据你们考察的实际情况,填写下表:

(5)根据你们收集的气候、植被、河流等资料和数据,科学家们绘制出了“世界陆地自然带分布”图。假若地球是平坦的,海岸线是直的,请你简化“世界陆地自然带的分布”图。
科目:gzdl 来源:新教材新学案 地理1必修(人教版) 题型:043
祝贺你和你的同学已被选为环球考察队成员。你们的任务是研究地球上地理环境的差异性,你要收集这些地区的气候、植被、河流、土壤等要素的资料与数据。你们这次考察的成果将被用作创建一个地理环境的信息数据库。指导你们考察的科学家已经着重选择了六个地区。你的行程将从寒风凛冽的北极苔原到水气蒙蒙的热带雨林。出发前务必整理好你的行装。
环球考察的第一站是赤道附近的热带雨林。这里不但炎热且潮湿,时常出现倾盆大雨,一阵阵雨过后,太阳又出来了。尽管阳光灿烂,但浓密的植被层的阳光还是很少的。
(1)从考察中你可以了解到地理环境各要素并不是彼此孤立的,而是作为一个整体存在的。请你把对这里河流的考察报告写出来,并分析形成本自然带的主导因素是什么。
考察的第二站是50°~70°N附近的亚寒带针叶林。这里最热月平均气温高于10℃,生长着大量的松、云杉、冷杉等耐寒的针叶树种,是森林资源宝库。
当到达考察的第三站时,这里的季节正是秋天,刀割一般的冷风使你们直接感受到苔原的气候特点。自然植被以苔藓、地衣为主,所以称为寒带苔原带。苔原地带的许多土地都是终年冰冻着。夏季每天光照时间是最长的,仲夏的太阳是不落的。这里的动物有驯鹿、北极狐等。
考察的第四站是沙漠,这里的年降水量少于250毫米,水的蒸发量远大于降水量,一天的温差通常很大。生活在沙漠中的生物既要适应缺水状况,又要适应温差大的恶劣条件,许多动物都是在晚上出来活动的。
考察的第五站是草原,这里的气温要比在沙漠里舒服许多,年降水量在250~270毫米之间,这片肥沃的土地上长满了牧草。
考察的第六站将带你到另一片森林——落叶阔叶林,这里冬天的气温在0℃以下,夏季早晨凉爽,白天仍很炎热,这里的树木每年树叶都会掉落。
(2)请你比较分析一下第六站处的森林与前面考察的热带雨林有何不同,并分析形成森林到沙漠自然带的主导因素是什么。
(3)指导你们考察的科学家要求你们写一篇考察报告,内容包括:分析是什么原因导致了这些地区地理环境差异的产生;以上考察的这些地区在分布上有什么规律可循。
(4)根据你们考察的实际情况,填写下表:

(5)根据你们收集的气候、植被、河流等资料和数据,科学家们绘制出了“世界陆地自然带分布”图。假若地球是平坦的,海岸线是直的,请你简化“世界陆地自然带的分布”图。
科目:gzdl 来源: 题型:069
祝贺你和你的同学已被选为环球考察队成员。你们的任务是研究地球上地理环境的差异性,你要收集这些地区的气候、植被、河流、土壤等要素的资料与数据。你们这次考察的成果将被用作创建一个地理环境的信息数据库。指导你们考察的科学家已经着重选择了六个地区。你的行程将从寒风凛冽的北极苔原到水气蒙蒙的热带雨林。出发前务必整理好你的行装。
环球考察的第一站是赤道附近的热带雨林。这里不但炎热且潮湿,时常出现倾盆大雨,一阵阵雨过后,太阳又出来了。尽管阳光灿烂,但浓密的植被层的阳光还是很少的。
(1)从考察中你可以了解到地理环境各要素并不是彼此孤立的,而是作为一个整体存在的。请你把对这里河流的考察报告写出来,并分析形成本自然带的主导因素是什么?
考察的第二站是50°~70°N附近的亚寒带针叶林。这里最热月平均气温高于10℃,生长着大量的松、云杉、冷杉等耐寒的针叶树种,是森林资源宝库。
当到达考察的第三站时,这里的季节正是秋天,刀割一般的冷风使你们直接感受到苔原的气候特点。自然植被以苔藓、地衣为主,所以称为寒带苔原带。苔原地带的许多土地都是终年冰冻着。夏季每天光照时间是最长的,仲夏的太阳是不落的。这里的动物有驯鹿、北极狐等。
考察的第四站是沙漠,这里的年降水量少于250毫米,水的蒸发量远大于降水量,一天的温差通常很大。生活在沙漠中的生物既要适应缺水状况,又要适应温差大的恶劣条件,许多动物都是在晚上出来活动的。
考察的第五站是草原,这里的气温要比在沙漠里舒服许多,年降水量在250~270毫米之间,这片肥沃的土地上长满了牧草。
考察的第六站将带你到另一片森林——落叶阔叶林,这里冬天的气温在0℃以下,夏季早晨凉爽,白天仍很炎热,这里的树木每年树叶都会掉落。
(2)请你比较分析一下第六站处的森林与前面考察的热带雨林有何不同?并分析形成森林到沙漠自然带的主导因素是什么。
(3)指导你们考察的科学家要求你们写一篇考察报告,内容包括:分析是什么原因导致了这些地区地理环境差异的产生;以上考察的这些地区在分布上有什么规律可循。
(4)根据你们考察的实际情况,填写下表:
(5)根据你们收集的气候、植被、河流等资料和数据,科学家们绘制出了“世界陆地自然带分布”图。假若地球是平坦的,海岸线是直的,请你简化“世界陆地自然带的分布”图。
科目:gzhx 来源: 题型:阅读理解
1996年诺贝尔化学奖授予对发现 ![]() 有重大贡献的三位科学家.
有重大贡献的三位科学家.![]() 分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:
分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:
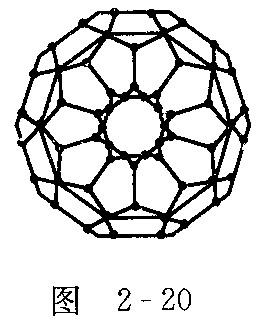
①![]() 分子中每个碳原子只跟相邻的3个碳原子形成化学键;②
分子中每个碳原子只跟相邻的3个碳原子形成化学键;②![]() 分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知
分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知![]() 分子有12个五边形和20个六边形,
分子有12个五边形和20个六边形,![]() 分子所含的双键数为30.请回答下列问题:
分子所含的双键数为30.请回答下列问题:
(1)固体![]() 与金刚石相比较,熔点较高者应是___________,理由是_________.
与金刚石相比较,熔点较高者应是___________,理由是_________.
(2)试估计![]() 跟
跟![]() 在一定条件下能否发生反应生成
在一定条件下能否发生反应生成![]()
![]() (填“可能”或“不可能”)________.并简述其理由:_______.
(填“可能”或“不可能”)________.并简述其理由:_______.
(3)通过计算,确定![]() 分子所含单键数为________.
分子所含单键数为________.
(4)![]() 分子也已制得,它的分子结构模型可以与
分子也已制得,它的分子结构模型可以与![]() 同样考虑而推知,通过计算确定
同样考虑而推知,通过计算确定![]() 分子中五边形和六边形的数目.
分子中五边形和六边形的数目.![]() 分子中所含五边形数为__________,六边形数为________.
分子中所含五边形数为__________,六边形数为________.
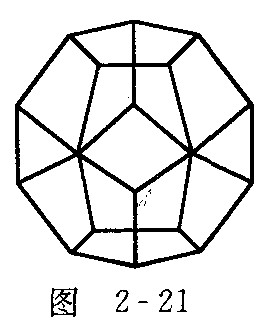
(5)德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子,如图2-21所示.这一成果刊登在2000年9月7日出版的英国《自然》杂志上.根据理论计算,包含20个碳原子、仅仅由正五边形构成的![]() 分子是富勒式结构分子中最小的一种.
分子是富勒式结构分子中最小的一种.![]() 中有__________个五边形;共有______条棱边.
中有__________个五边形;共有______条棱边.
(6)目前,科学家拟合成一种“二重构造”的球型分子,即把“足球型”的![]() 与“足球型”的
与“足球型”的![]() 的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
①你认为![]() 与
与![]() 的分子应采取怎样的镶嵌_________,理由是________.
的分子应采取怎样的镶嵌_________,理由是________.
②“二重构造”后的晶体属于_________晶体,其熔点与![]() 、
、![]() 相比_______.
相比_______.
(7)最近有人用一种称为“超酸”的化合物![]() 和
和![]() 反应,使
反应,使![]() 获得一个质子,得到一种新型离子化合物
获得一个质子,得到一种新型离子化合物![]() .回答如下问题:
.回答如下问题:
①以上反应类型上可以跟中学化学课本中的一个化学反应相比拟,后者是_______________________.
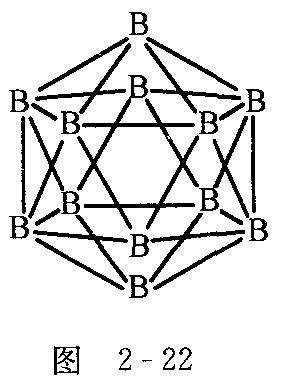
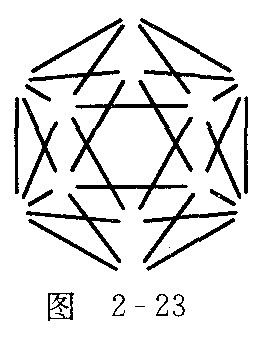
②上述阴离子![]() 的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,
的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,![]() 子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.
子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.
科目:gzsx 来源: 题型:
| A、15 | B、16 | C、17 | D、18 |
科目:czhx 来源: 题型:阅读理解
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
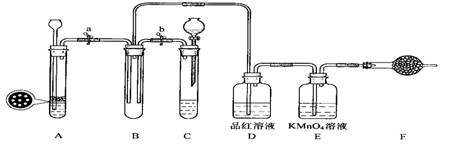
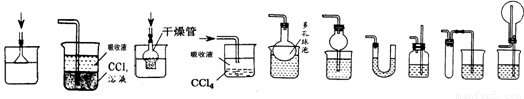
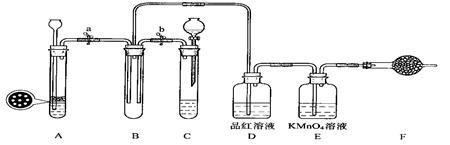
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。
回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:
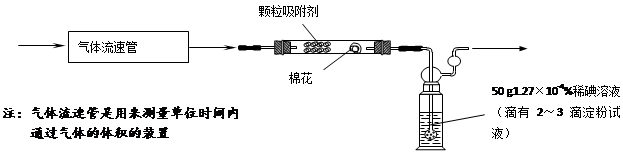
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J
科目:czhx 来源: 题型:阅读理解
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
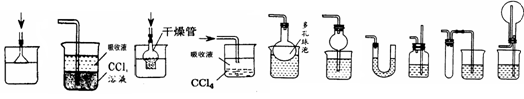
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。
A B C D E F G H I J
科目:czhx 来源:2011-2012学年度云南省蒙自市博通学校初三综合复习化学试卷(带解析) 题型:探究题
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |



科目:czhx 来源:2012届度云南省初三综合复习化学试卷(解析版) 题型:探究题
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
|
测定时刻 |
5∶05 |
5∶10 |
5∶15 |
5∶20 |
5∶25 |
5∶30 |
5∶35 |
|
pH |
4.95 |
4.94 |
4.94 |
4.88 |
4.86 |
4.85 |
4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO2 气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100 mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2 气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J
科目:czhx 来源:2011-2012学年云南省蒙自市博通总校初三化学综合复习化学试卷 题型:探究题
空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
|
测定时刻 |
5∶05 |
5∶10 |
5∶15 |
5∶20 |
5∶25 |
5∶30 |
5∶35 |
|
pH |
4.95 |
4.94 |
4.94 |
4.88 |
4.86 |
4.85 |
4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO2 气体能使品红溶液、高锰酸钾溶液褪色。
回答以下问题:
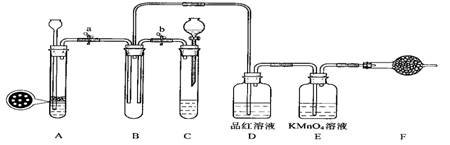
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100 mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2 气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。
A B C D E F G H I J
科目:czhx 来源:不详 题型:实验题
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |



科目:czwl 来源: 题型:阅读理解
2008初中物理中考模拟练习题(二)
(120分钟,100分)
一、判断题(每题1分,共10分)
1.弹簧秤的刻度是均匀的,是因为弹簧的伸长跟它所受的拉力成正比。 ()
2.使用滑轮组能省多少力,只与动滑轮的个数有关。 ()
3.一节干电池的电压为1.5伏,这就是说:在由它作电源的电路里,每秒钟电流做功为1.5焦耳。 ()
4.在“测定滑轮组的机械效率”的实验中,对于给定的一个滑轮组,若在动滑轮下面分别挂200克或400克砝码时,这个滑轮组的机械效率不会发生变化。 ()
5.光沿着镜面的法线入射在镜面上,传播方向将不会改变。 ()
 每千克摄氏度 ()
每千克摄氏度 ()
8.眼睛能看到镜子里的像,是由于像发出的光线射入眼睛中的缘故。 ()
9.通过导体的电量越多,那么导体中的电流强度就越大。 ()
10.一根铁棒在磁场中作切割磁感线运动时,铁棒两端能产生感应电压,但棒中不能产生感应电流。 ()
二、填空题(每题1分,共22分)
1.已知大气压为760毫米汞柱,如图2-1s所示的托里拆利实验中,管内水银上方是真空,则管内A点的压强为__________毫米汞柱,槽内B点的压强为__________毫米汞柱。
 时,受到__________牛顿的浮力,这时把铁块挂在弹簧秤上,弹簧秤的读数为__________牛顿。
时,受到__________牛顿的浮力,这时把铁块挂在弹簧秤上,弹簧秤的读数为__________牛顿。
3.一个工人用一个动滑轮提升重物,动滑轮的机械效率为90%,他作用在绳上的拉力为250牛顿,则此重物为__________牛顿。
4.灯泡上标有“220V 40W”字样,它正常发光时,电流强度为__________安,电阻为 ,2秒钟内通过它的电量为__________,2秒钟内电流所作的功为__________。
 桌面上,用20牛顿的力竖直向下压它,桌面受到的压强是__________帕斯卡,用20牛顿的力竖直向上提它,则桌面受到的压强是__________帕斯卡。
桌面上,用20牛顿的力竖直向下压它,桌面受到的压强是__________帕斯卡,用20牛顿的力竖直向上提它,则桌面受到的压强是__________帕斯卡。
 焦/(千克·℃),若将该金属块的质量减少2倍,加热时间增加一倍,则这时所测得的该金属块的比热为__________焦/(千克·℃)。
焦/(千克·℃),若将该金属块的质量减少2倍,加热时间增加一倍,则这时所测得的该金属块的比热为__________焦/(千克·℃)。
7.1820年丹麦物理学家 ,发现了电流周围存在着__________,我国宋代科学家__________,是世界上第一个清楚地、准确地论述磁偏角的科学家。

9.开口容器里的液体在任何温度下都一定是处在物态变化中的__________过程;这个过程中只在液体的__________上发生。
10.在射击瞄准中有一个要领叫做“三点一直线”,这是利用了光__________的原理。光从空气斜射到水中,当入射角逐渐增大时,折射角将__________。
三、选择题:(每题2分,共24分)
 ()
()
2.已知铝的密度小于铜的密度,分别用铝和铜做一个实心球,下面哪种情况是不可能的: ()
3.下列关于压力的说法哪个正确: ()
4.一个物体不带电,是因为它: ()

 10米深水中的物体匀速提高2米,则拉力对重物做功为: ()
10米深水中的物体匀速提高2米,则拉力对重物做功为: ()
7.一只空心球总体积为V,球腔容积为V/2,当腔内不灌水时,它在水中有一半露出水面,若将球腔内注满水再放入水中,则: ()
8.在下列现象中属于光的折射的是: ()
9.如图2-3所示四个电路中,属于并联电路的正确图是: ()
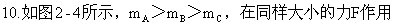 下,三个物体都沿力的方向分别移动了距离S,则力F所做的功是:()
下,三个物体都沿力的方向分别移动了距离S,则力F所做的功是:()
11.根据分子运动论,下列说法中错误的是 ()
 [ ]
[ ]
四、实验题:(1题6分,2题9分,共15分)
1.在测量滑轮组的机械效率的实验中,所用器材有:(a)刻度尺;(b)弹簧秤(测力范围0-3牛顿)(c)滑轮四只,每只重2.5牛顿;(d)适当长的细绳。
(1)根据现有的实验器材,在图2-5所示的四个滑轮组中,只有选用图 滑轮组,才能用最小的力提起6.8牛顿的重物,并画出该滑轮绳子的绕法。
2.如图2-6所示是用来测定额定电压为2.5伏的小灯泡的额定功率,(1)图中C表应是__________表,D表应是__________表。(2)当合上电键时,发现灯泡两端电压为2伏,这时滑动触头应向__________方移动,直到表的指针为__________时,灯泡正常发光。这时应记录的数据是__________与__________,灯泡额定功率的表达式P=__________。
(3)上述实验中如果D表有读数,C表无读数,毛病可能是__________;若C表有读数,D表无读数,毛病可能是__________。
五、作图题(每题2分,共8分)
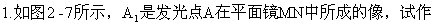 出该发光点发出的一条光线经平面镜反射后通过B点的光路图。(标出发光点A和入射点O的位置)。
出该发光点发出的一条光线经平面镜反射后通过B点的光路图。(标出发光点A和入射点O的位置)。
2.如图2-8所示,用力的图示法,画出质量为2kg的小球沿斜面滚下时所受的重力。
3.根据图2-9中所给通电导体的电流方向,标出磁针的N、S极和磁力线的方向。
4.作出2-10中杠杆所受各力的力臂(O为支点)。
六、计算题(每题7分,共21分)
 水中,至少需在木块下吊多大质量的铁球?
水中,至少需在木块下吊多大质量的铁球?
