科目:gzhx 来源: 题型:
| 放电 | 充电 |
科目:gzhx 来源: 题型:阅读理解
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
| 光照/叶绿素 |
| ||
| △ |
| ||
| △ |
| ||
| △ |
科目:gzhx 来源:2011普通高等学校招生全国统一考试化学卷(四川) 题型:填空题
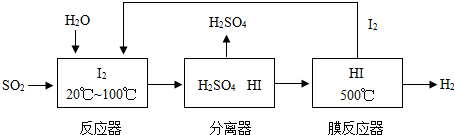
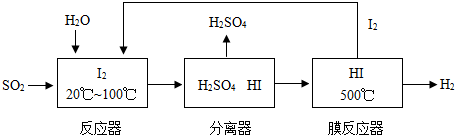
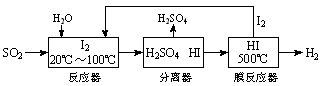
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。

请回答下列问题:
(1)已知1gFeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______________。
(2)该循环工艺过程的总反应方程式为_____________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
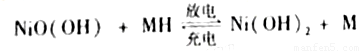
①电池放电时,负极的电极反应式为____________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为______________
科目:gzhx 来源:四川 题型:问答题
| 放电 |
| 充电 |
科目:gzhx 来源:2011年四川省高考化学试卷(解析版) 题型:解答题

 Ni(OH)2+M
Ni(OH)2+M科目:gzhx 来源:模拟题 题型:填空题
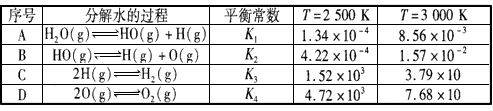
 H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。
H2(g)+1/2O2(g),平衡常数K=___(用含K1、K2、K3、K4的式子表示)。 H2 (g) +1/2O2 ( g) △H=-___kJ/mol。
H2 (g) +1/2O2 ( g) △H=-___kJ/mol。 

科目:gzhx 来源:四川省高考真题 题型:填空题
 Ni(OH)2+M
Ni(OH)2+M 科目:gzhx 来源: 题型:
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。

请回答下列问题:
(1) 已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为____________________________________________________。
(2) 该循环工艺过程的总反应方程式为______________________________________。
(3) 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是______ _____________________________________________________________________。
(4) 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH) + MH![]() Ni(OH)2 + M
Ni(OH)2 + M
①电池放电时,负极的电极反应式为_________________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________________________________。
科目:gzhx 来源:2011普通高等学校招生全国统一考试化学卷(四川) 题型:填空题
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
请回答下列问题:
(1)已知1gFeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______________。
(2)该循环工艺过程的总反应方程式为_____________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
(4)用吸收H2后的稀 土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
①电池放电时,负极的电极反应式为____________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为______________
科目:gzhx 来源: 题型:
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
请回答下列问题:
(1)已知1gFeS2完全燃烧放出7.1kJ热量,FeS2燃烧反应的热化学方程式为______________。
(2)该循环工艺过程的总反应方程式为_____________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是____________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
①电池放电时,负极的电极反应式为____________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为______________
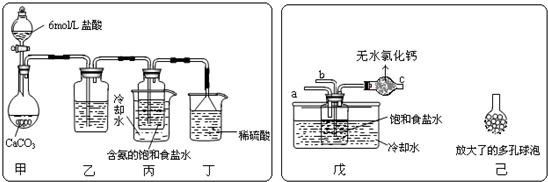
科目:gzhx 来源: 题型:阅读理解
| ||
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| A、铜锌原电池中铜是正极 | B、用电解法精炼粗铜时,粗铜作阳极 | C、在镀件上电镀铜时可用金属铜作阳极 | D、电解稀硫酸制H2、O2时,铜作阳极 |
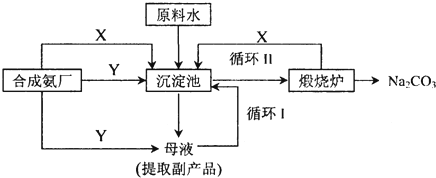
科目:gzhx 来源: 题型:阅读理解
| 温度溶解度盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| c(V2-V1)M |
| 1000W |
| c(V2-V1)M |
| 1000W |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
| 1 |
| 2 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/(mol•L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
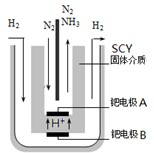 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为