
题目列表(包括答案和解析)
1.下列变化属于化学变化的是
(A)潮湿的衣服经太阳晒,变干了
(B)寒冷的冬天在玻璃窗前呼吸,玻璃上出现一层水雾
(C)铜在潮湿的空气里生成铜绿
(D)下雪天把一团雪放在温暖的房间里,雪融化
27.(6分)在一次化学课外活动中,某同学想除去氯化钾固体中混有的氯化铜(不引进其他杂质)。化学老师为他提供了以下溶液:氢氧化钠溶液、氢氧化钾溶液、硫酸钠溶液。该同学现取氯化钾和氯化铜的混合物59.8g,全部溶解在200g水中,再加入60g所选溶液,恰好完全反应,生成沉淀9.8g。
试回答:(1)该同学所选的是 溶液;
(2)计算混合物中氯化铜的质量和反应后所得溶液中溶质的质量分数。(计算结果精确到0.1%)
zk5u天津市2009年中考预测试卷-化学
27.(4分)铜和锌的混合物10g与100g稀硫酸恰好完全反应,生成0.2g氢气。
求:(1)混合物中铜的质量;(2)该稀硫酸中的溶质的质量分数。
26.(7分) 在学习了质量守恒定律后,小明和小华来到实验室,他们用右下图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的。
在学习了质量守恒定律后,小明和小华来到实验室,他们用右下图所示的实验装置,验证了氢氧化钠溶液和硫酸铜溶液反应是符合质量守恒定律的。
(1)请写出该反应的化学方程式 ;
(2)实验结束后,在整理仪器时小明发现,原来氢氧化钠溶液是放在敞口容器中。于是他们对刚刚完成的实验产生了疑问:
[提出问题]①氢氧化钠是否变质;
②如果氢氧化钠溶液已经变质,“变质”的氢氧化钠溶液与硫酸铜溶液反应为什么仍然符合质量守恒定律。
[查找资料]部分铜盐的溶解性表(20℃)
|
阳离子阴离子 |
SO42- |
NO3- |
PO43- |
Cl- |
CO32- |
|
Cu2+ |
溶 |
溶 |
不 |
溶 |
不 |
(3)请你帮助他们完成下面的探究:
他们依据所学知识,对氢氧化钠样品溶液的溶质成分作了如下猜想:
[猜想] ① 可能是NaOH; ② 可能是Na2CO3; ③ 可能是NaOH与Na2CO3的混合物。
[设计实验] Ⅰ 取少量样品溶液,滴加稀盐酸,有气体生成。由此认为猜想②正确。请判断此结论是否正确,并简述理由。 ______________________________。
Ⅱ 取少量样品溶液,滴加酚酞试液,溶液变为红色。由此认为猜想①正确。请判断此结论是否正确,并简述理由。______________________________。
Ⅲ 取少量样品溶液,滴加BaCl2试液,有白色沉淀产生。由此判断白色粉末中含有________。为了验证猜想③,继续向溶液中滴加BaCl2试液至不再产生沉淀,然后过滤。接下来还应进行的实验是__________ ______,若观察到 现象,则猜想③正确。
[解释与分析]①假如氢氧化钠已变质。
②“变质”的氢氧化钠溶液与硫酸铜溶液反应,为什么仍然符合质量守恒定律:
。
25.(6分)有一包固体粉末,可能含有碳酸钙、硫酸铜、硝酸钾、硫酸钠、氯化钡中的一种或几种。为确定其组成,进行如下实验:
(1)取该固体粉末少量加足量水,搅拌,静置,得到白色沉淀,上层为无色溶液;
(2)过滤,在白色沉淀中加入足量稀硝酸,白色沉淀不溶解。
根据以上实验可推断原固体粉末中一定有的物质是 ;一定没有的物质是 ;不能确定的物质是__ ______;为确定这包固体粉末的组成,小华取原固体粉末8.00g加足量水充分溶解后,其粉末中的成分恰好完全反应,过滤,将沉淀洗涤、干燥。称得其质量为4.66g。通过计算后,确定这包固体粉末的组成是_____________________。
24.
 (12分)(1)实验室中常用氯酸钾和二氧化锰加热制氧气、锌粒与稀硫酸反应制氢气、石灰石与稀盐酸制二氧化碳气体。
(12分)(1)实验室中常用氯酸钾和二氧化锰加热制氧气、锌粒与稀硫酸反应制氢气、石灰石与稀盐酸制二氧化碳气体。



A B C D E
写出标号仪器的名称① ②
请结合所给药品选择适当的气体发生和收集装置填入下表:(填字母)
|
气体 |
发生装置 |
收集装置 |
|
O2 |
|
|
|
H2 |
|
|
|
CO2 |
|
|
(2)由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。
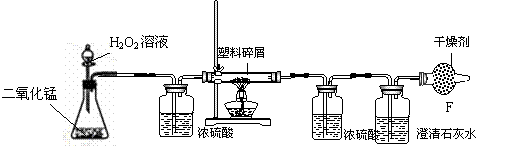
A B C D E
①仪器B的作用是 。
②仪器E中的现象是 。 ③若仪器C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若仪器D增重a g,则Wg该塑料试样中含氢元素的质量为 g(计算结果可为分数形式)
④若装置中没有连接仪器B,将使该塑料试样中氢元素的质量测算结果 (填“偏小”、“偏大”、“无影响”中之一)。
23.(5分)(1)有硫酸亚铁、硫酸铜的混合溶液,向其中投入一些锌粉,充分反应后过滤,得到滤液和一些固体不溶物。向固体不溶物中加入少量稀硫酸,有气泡产生。则固体不溶物中一定含有的物质为_____________,可能含有的物质为_____________;滤液中一定含有的溶质为_____________。
(2)某化学兴趣小组,设计了验证Fe、Cu、Ag的金属活动性顺序的多种方案,每种方案所需的试剂如下:①Fe、CuSO4溶液、Ag ②FeCl2溶液、Cu、AgNO3溶液 ③Fe、Cu、AgNO3溶液 ④Fe、Cu、稀盐酸、AgNO3溶液 ⑤FeSO4溶液、Cu、Ag。你认为可行的方案是 。(填序号)
22.(5分)常见金属D的制取与转化关系如下(有些反应物和生成物已略去):
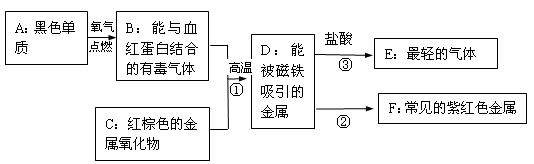
(1)写出下列物质的化学式:A是 ;C是 ;E是 ;
(2)写出上图中②反应的化学方程式: ;
(3)反应③的基本反应类型是: 。
21.(5分)按要求写出下列反应的化学方程式。
(1)镁带在氧气中燃烧
(2)二氧化碳通入足量的澄清石灰水中
(3)铜丝插入的硝酸汞溶液中
(4)加热氯酸钾和二氧化锰的混合物制取氧气
(5)硝酸银溶液与稀盐酸混合
20.(2分)在反应2A+B=====3C+D中,A和B的相时分子质量之比为5:1,已知20g A与一定量B恰好完全反应,生成5g D,则在此反应中B和C的质量比为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com