
题目列表(包括答案和解析)
22、(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(2)量取反应物时,取50 mL 0.50 mol· L-1的盐酸,还需加入的试剂是 (填序号)。
A.50 mL 0.50 mol· L-1 NaOH溶液
B.50 mL 0.55 mol· L-1 NaOH溶液
C.1.0 g NaOH固体
(3)已知稀盐酸与稀氢氧化钠溶液反应的中和热ΔH=-57.3 kJ·mol-1,请用离子方程式表示该中和反应的热化学方程式 。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为 。
21、下图中A、B、C、D、E、F、G均为有机化合物。
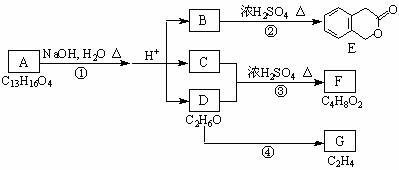
根据上图回答问题:
(1)D的化学名称是_____________;
(2)反应③的化学方程式是 ;
反应④的化学方程式是 ;
(3)B的分子式是_____________;
A的结构简式是__________________________;反应①的反应类型是___________;
(4)符合下列3个条件的B的同分异构体的数目有 个;
①含有邻二取代苯环结构; ②与B有相同官能团; ③不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 ;
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途:
。
20、甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出甲池中正极的电极反应式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则此时溶液的pH= 。(不考虑电解产物的相互反应)
19、短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如下图所示转化(部分产物已略去):
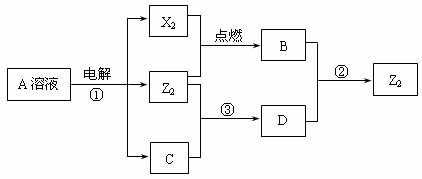
(1)Y在周期表的位置是______________________ _;Z2的结构式是________________。
(2)反应①的离子方程式是______________________________________________________。
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应

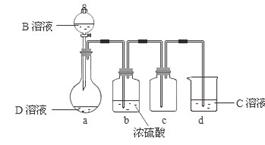
I、 写出反应②的离子方程式_____________________ ___________。
II、上述实验装置不够完善,改进方法是 。
Ⅲ、足量Z2 通入FeBr2溶液中发生反应的离子方程式是 。
18、元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式) 。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程 。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热
化学方程式 。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,
写出该反应的化学方程式 。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为 ;若B为常见家用消毒剂的主要成分,则B的化学式是 。
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是 ;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
17、下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
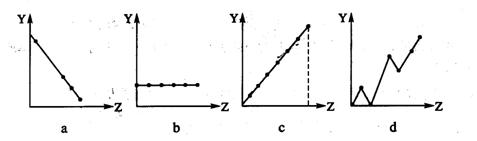
(1)ⅡA族元素的最外层电子数 。
(2)第3周期元素的最高化合价 。
(3)F-、Na+、Mg2+、Al3+的离子半径 。
16、将x mol Al2O3和y mol CuO混合后,全部溶于V L过量的稀硫酸中,然后向溶液中逐渐加入0.5 mol/L的NaOH溶液,当加入a L时,生成的沉淀最多,则原稀H2SO4的物质的量浓度为
A. mol/L B.
mol/L B.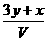 mol/L C.
mol/L C.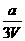 mol/L
D.无法计算
mol/L
D.无法计算
15、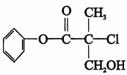 某有机物A 是农药生产中的一种中间体,其结构简式如下。下列叙述中正确的是
某有机物A 是农药生产中的一种中间体,其结构简式如下。下列叙述中正确的是
A.有机物A 属于芳香烃 B.有机物A 可以与Br2的CCl4溶液发生加成反应
C.有机物A 与浓硫酸混合加热,可以发生消去反应
D.1 mo1A 与足量的NaOH 溶液反应,最多可以消耗3mol NaOH
14、氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电
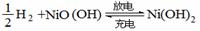 池的总反应为
。据此判断,下列叙述中正确的是
池的总反应为
。据此判断,下列叙述中正确的是
A.电池放电时,H2是正极
B.电池放电时,溶液中的阳离子移向正极
C.电池充电时,氢元素被氧化
D.电池放电时,电池负极周围溶液的pH不断增大
13、一定能在下列溶液中大量共存的离子组是
A.pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的c(H+)=1×10-13mol / L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=14的溶液:Na+、K+、AlO2-、CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com