
题目列表(包括答案和解析)
2、用nA表示阿伏加德罗常数的值,下列叙述正确的是
A.1 mol -CH3和1 mol OH- 都含有10 nA个电子
B.标准状况下3.36 L CCl4含碳原子数为0.15nA
C.2 molHF溶于水配成溶液中含F- 2nA
D.46gNO2和N2O4混合气体中含氧原子数为2nA
1、北京奥运会 “水立方” 游泳池中的水主要是通过砂滤、臭氧和活性炭来净化的,下列有
关说法不正确的是
A.砂滤是利用过滤原理除去水中较大的固体颗粒
B.臭氧可以消毒杀菌是因为臭氧有强氧化性
C.游泳池水中的臭氧浓度越大越好
D.活性炭可以吸附水中悬浮的杂质
25.(9分)
目前加碘食盐的添加剂是碘酸钾,碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生的反应方程式为:6I2 +11KClO3 +3H2O =6KH(IO3)2 +5KCl +3Cl2↑。试回答下列问题:
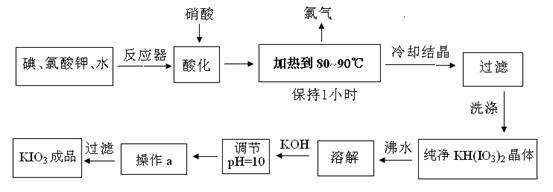
(1)对反应产物酸化时,用硝酸而不用HI,其原因可能是
(2)要保持溶液微沸(加热到80~90℃)1小时,以完全排出氯气。检验氯气已完全排出简单实验方法是 。
(3)合成实验中涉及两次过滤,在实验室进行过滤实验时,用到的玻璃仪器有 。
(4)在过滤器上洗涤沉淀的操作是:向漏斗里注入 。
(5)参照碘酸钾与氢氧化钾溶解度曲线,操作a得到碘酸钾晶体,你建议的方法是
|
温度 |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
|
KOHg/100g水 |
49.2 |
50.8 |
52.8 |
59.8 |
62.4 |
78.6 |
24.(18分)
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
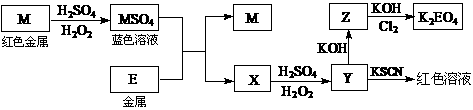
(1)用化学符号表示: X___________、Z___________
(2)写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
H2O2在反应中所起的作用是___________,生成1mol M SO4转移电子____mol
(3)同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: ______ 、 ___________ 。
(4)写出Y与KSCN反应的离子方程式
现今自来水厂常用K2EO4代替氯气进行水处理,主要是利用K2EO4的__________性对自来水进行________________。
23.(12分)
硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
|
指标 项目 |
优等品 |
一等品 |
合格品 |
|
外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
|
氮(N)含量 |
≥21.0% |
≥21.0% |
≥20. 5% |
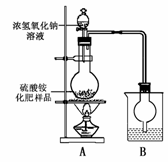 某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验探究]按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:______________
烧杯中盛放的试剂最好是___________ (填“浓硫酸”、“稀硫酸”或“水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是_________________。
[交流讨论] 甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:________________________________。
乙同学:实验装置中还存在另一个明显缺陷是:______________________________。
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论] 称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥___________ (填“是”或“不是”)一等品。
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。对可能产生的现象有如下假设:
假设①:有明显现象;
假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是_______________________。
(5)基于假设②,结论是_________________________________________________, 请设计实验进一步验证该结论,叙述实验操作:________________________ ________________________________________________________________。
22.(16分)
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:


回答下列问题:
(1) 工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是: ______________________________ 。
(2) 从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,欲除去少量Ca(OH)2尽量避免的Mg(OH)2损失的可采取的方法是先将沉淀加入到盛有 _____ 溶液的烧杯中,充分搅拌后经 _____ 、 _____ (填操作方法)可得纯净的Mg(OH)2。在Mg(OH)2中加入稀盐酸溶解发生反应的离子方程式为 _________________________________________________
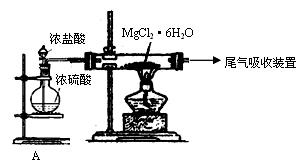 (3)下图是该兴趣小组设计进行过程③的实验装置图:
(3)下图是该兴趣小组设计进行过程③的实验装置图:
其中装置A的作用是 。 硬质玻璃管内发生反应的方程式为: 。
若没有设计A装置,直接加热MgCl2·6H2O实验,可能出现的结果是
(4)写出过程④中发生反应的化学方程式 。
该消毒液对碳钢制品是否有腐蚀作用?
36.(9分)取一定量的Na2CO3、NaHCO3和Na2SO4的混合物与250mL 1moL/L过量盐酸反应,生成2.016LCO2(标准状态).然后加入500mL 0.1moL/LBa (OH)2溶液,得到沉淀的质量为2.33克,.溶液中过量的碱用10mL 1moL/L盐酸恰好完全中和.计算混合物中各物质的质量.
35。(5分)写出(1)钠原子结构示意图 (2)氯化氢的电子式 (3)氧族元素第四周期元素符号 (4)电解精炼铜阴极电极方程式
34.(12分)将加热至红热的2.4g木炭投入盛有足量12mol·L-1的浓HNO3的试管中,立即塞好塞子,如图所示,连接好(事先已检查装置的气密性)。请回答:

(1)反应开始后撤去酒精灯,试管a中除看到木炭剧烈燃烧,最后消失外,还观察到的
现象是 ;
(2)试管中b最终 沉淀产生(填“有”、“无”),原因是
。
(3)试管c中发生反应的化学方程式为 ;
(4)集气瓶e中最后收集到的气体为 ,理论上该气体的总体积为
L(标准状况时),实际上这个数值 (填“大”“小”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com